Braftovi y Mektovi
Encorafenib está indicado:
• En combinación con Binimetinib en adultos para el
tratamiento del melanoma no resecable o metastásico con
mutación BRAF V600.
• En combinación con Cetuximab, para el tratamiento de
pacientes adultos con cáncer colorrectal metastásico
(CCRm) con mutación BRAF V600E, que han recibido terapia
sistémica previa.
Binimetinib está indicado:
• En combinación con Encorafenib en pacientes adultos
para el tratamiento del melanoma no resecable o
metastásico con mutación BRAF V600.




1. Presented at ASCO 2020. Gogas.HJ, et al. Poster 10012. www.asco.org . 2. 1. Stuart DD, et al. AACR. 2012: abstract 3790 . 3. Gogas H, et al. Eur J Cancer 2021;152:116–128
La combinación de BRAFTOVI + MEKTOVI permite una eficacia potente y sostenida(9,10) en el tiempo gracias a las propiedades de PK/PD que pueden traducirse en mejores resultados clínicos y una mayor tolerabilidad para sus pacientes(5).
5. Ascierto PA, Dummer R, Gogas HJ et al. Update on tolerability and overall survival in COLUMBUS: landmark analysis of a randomised Phase 3 trial of encorafenib plus binimetinib vs vemurafenib or encorafenib in patients with BRAFV600-mutant melanoma. Eur J Cancer 2020;126:33–44.
9. Trojaniello C, Festino L, Vanella V et al. Encorafenib in combination with binimetinib for unresectable metastatic melanoma with BRAF mutation. Expert Rev Clin Pharmacol 2019;12(3):259–266.
10. Heinzerling L, Elgentler TK, Fluck M et al. Tolerability of BRAF/MEK inhibitor combinations: adverse event evaluation and management. ESMO Open 2019;4(3):e0004912019;4(3):e000491
-
1. Nombre del medicamento
Braftovi 50 mg cápsulas duras
Braftovi 75 mg cápsulas duras
-
2. Composición cualitativa y cuantitativa de los principios activos
Braftovi 50 mg cápsulas duras
Cada cápsula dura contiene 50 mg de encorafenib.
Braftovi 75 mg cápsulas duras
Cada cápsula dura contiene 75 mg de encorafenib.
Para consultar la lista completa de excipientes, ver sección 6.1.
-
3. Forma farmacéutica
Cápsula dura (cápsula).
Braftovi 50 mg cápsulas duras
Tapa de la cápsula naranja opaca y cuerpo de color carne opaco, con una “A” impresa en la tapa de la cápsula y “LGX 50mg” impreso en el cuerpo. La longitud de la cápsula es de 22 mm, aproximadamente.
Braftovi 75 mg cápsulas duras
Tapa de la cápsula de color carne opaca y cuerpo blanco opaco, con una “A” impresa en la tapa y “LGX 75mg” impreso en el cuerpo. La longitud de la cápsula es de 23 mm, aproximadamente.
-
4. Datos clínicos
- en combinación con binimetinib en adultos para el tratamiento del melanoma no resecable o metastásico con mutación BRAF V600 (ver las secciones 4.4 y 5.1).
- en combinación con cetuximab, para el tratamiento de pacientes adultos con cáncer colorrectal metastásico (CCRm) con mutación BRAF V600E, que han recibido terapia sistémica previa (ver las secciones 4.4 y 5.1).
- Grado 4
- Grado 2 (aspartato aminotransferasa (AST) o alanina aminotransferasa (ALT) >3 a ≤5 veces el límite superior normal (LSN))
- Primer acontecimiento de Grado 3 (AST o ALT >5 veces el LSN y bilirrubina en sangre >2 veces el LSN)
- Primer acontecimiento de Grado 4 (AST o ALT >20 LSN)
- Acontecimiento recurrente de Grado 3 (AST o ALT >5 veces el LSN y bilirrubina en sangre >2 veces el LSN)
- Acontecimiento recurrente de Grado 4 (AST o ALT >20 LSN)
- Elevación de transaminasas: 15,7% (43/274) global; Grado 3 o 4: 5,5% (15/274)
- Elevación de la GGT: 14,6% (40/274) global; Grado 3 o 4: 8,4% (23/274)
- Elevación de transaminasas: 13,2% (34/257) global; Grado 3 o 4: 5,4% (14/257)
- Elevación de la GGT: 14,0% (36/257) global; Grado 3 o 4: 4,7% (12/257)
4.1 Indicaciones terapéuticas
Encorafenib está indicado:
4.2 Posología y forma de administración
El tratamiento con encorafenib se debe iniciar y supervisar bajo la responsabilidad de un médico con experiencia en el uso de medicamentos antineoplásicos.
Posología
Melanoma
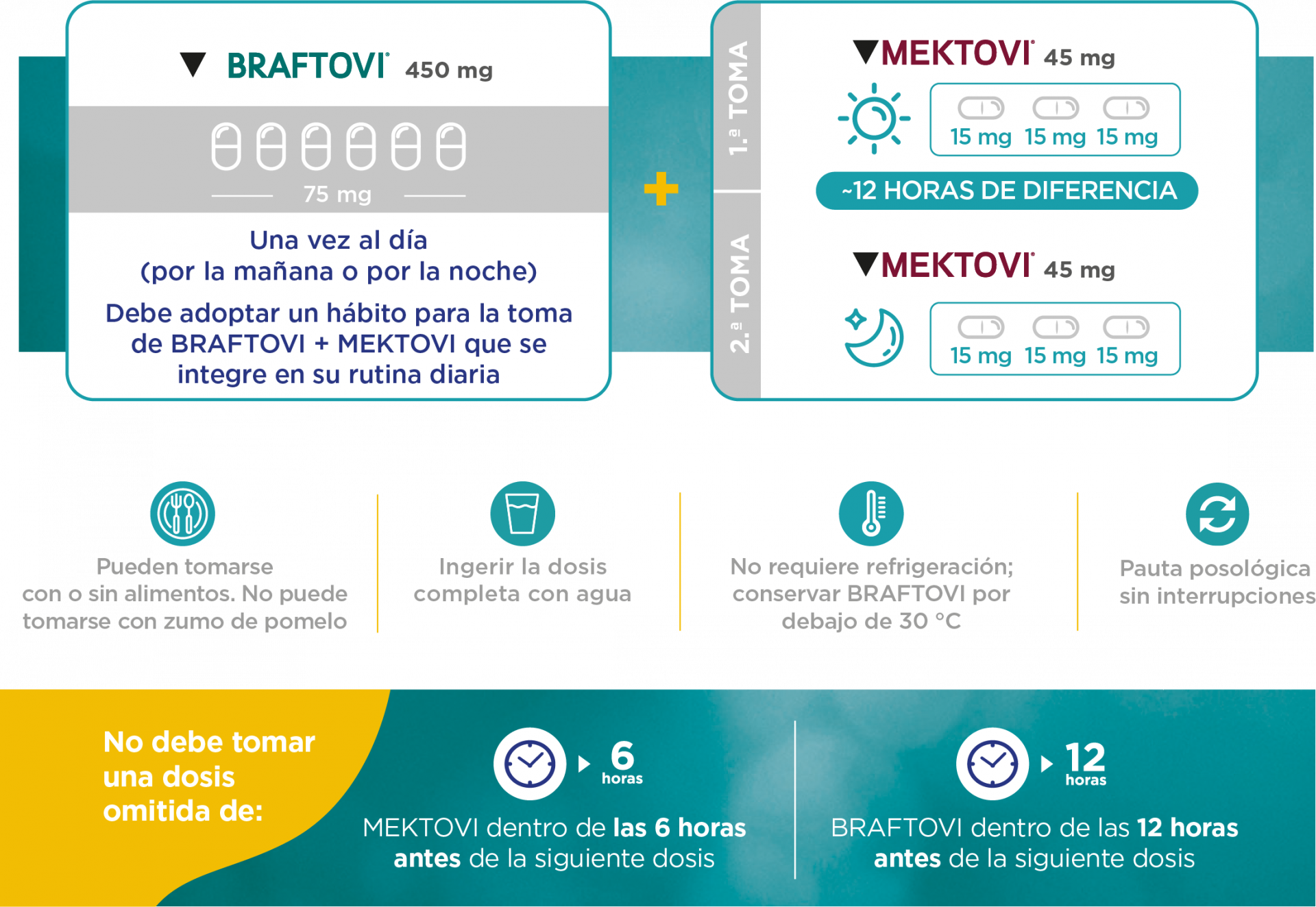
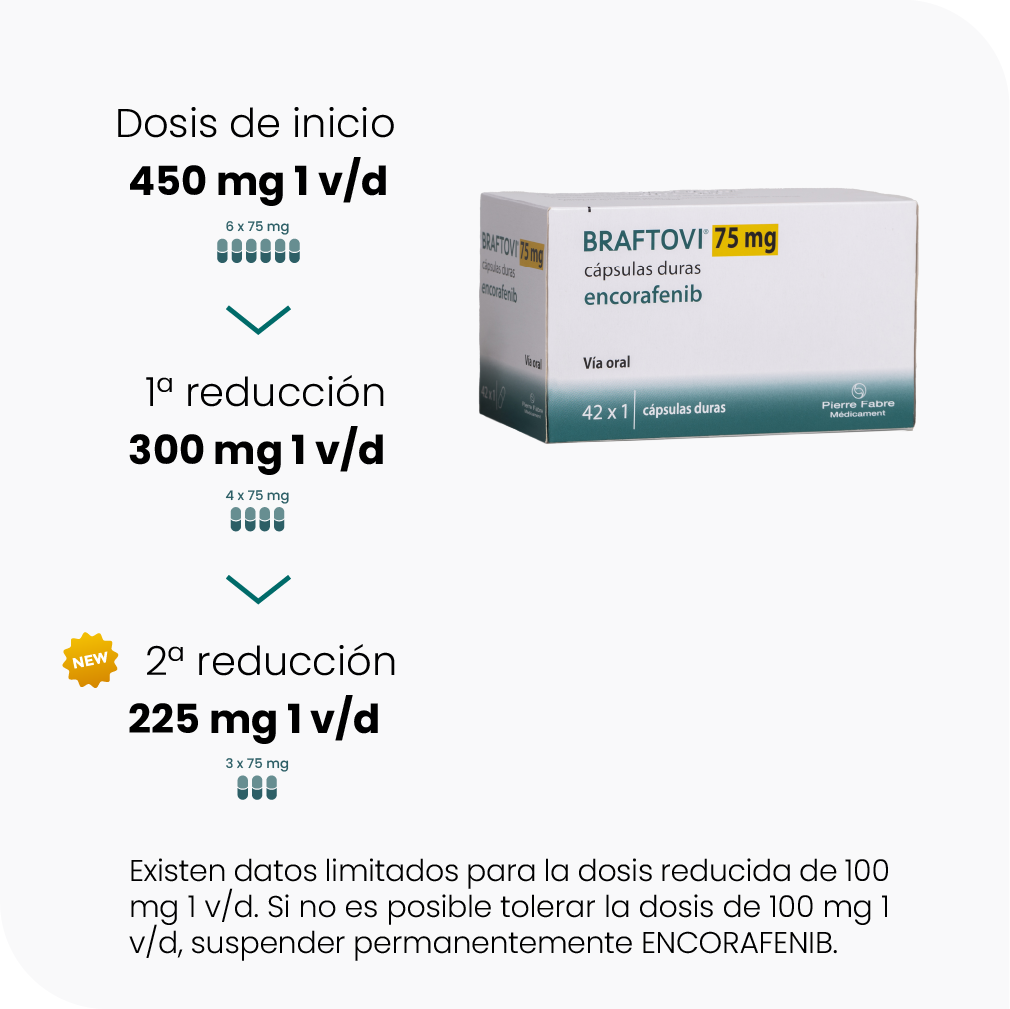
La dosis recomendada de encorafenib es de 450 mg (seis cápsulas de 75 mg) una vez al día, cuando se utiliza en combinación con binimetinib.
Cáncer colorrectal
La dosis recomendada de encorafenib es de 300 mg (cuatro cápsulas de 75 mg) una vez al día, cuando se utiliza en combinación con cetuximab.
Modificación de la dosis
Melanoma
Para controlar las reacciones adversas puede ser necesario reducir la dosis, interrumpir temporalmente la administración o suspender el tratamiento de encorafenib (ver las tablas 1, 3 y 4).
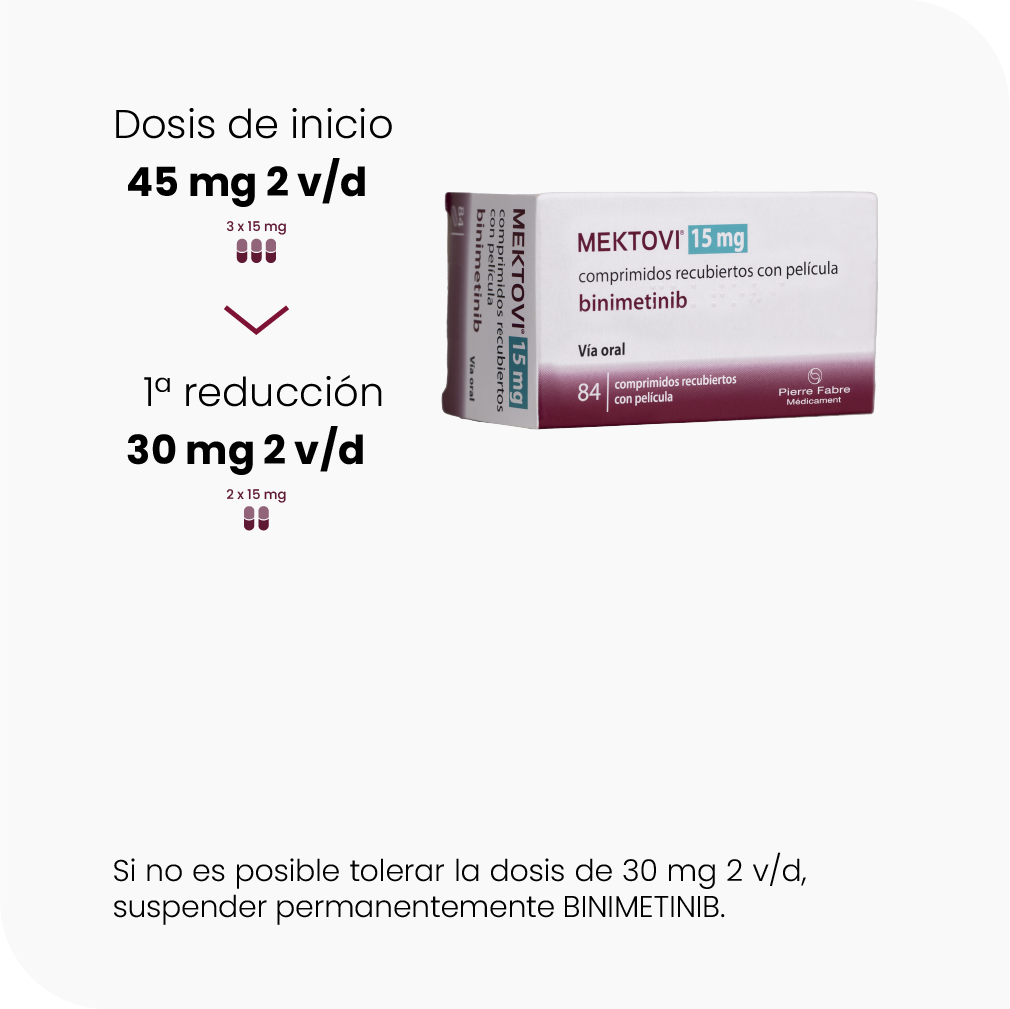
Para obtener información sobre la posología y las modificaciones de dosis recomendadas de binimetinib, consulte la sección 4.2 de la Ficha Técnica de binimetinib
En la tabla 1 se indican las recomendaciones para la reducción de la dosis de encorafenib.
Tabla 1: Modificaciones de dosis recomendadas para encorafenib cuando se utiliza en combinación con binimetinib en la indicación de melanoma
Nivel de dosis Dosis de encorafenib cuando se utiliza en combinación con binimetinib
Dosis inicial Seis cápsulas de 75 mg (450 mg) una vez al día 1ª reducción de la dosis Cuatro cápsulas de 75 mg (300 mg) una vez al día 2ª reducción de la dosis Tres cápsulas de 75 mg (225 mg) una vez al día Modificaciones posteriores Hay datos limitados para la reducción de dosis a 100 mg una vez al día. Se debe suspender de forma permanente el tratamiento con encorafenib si el paciente no puede tolerar 100 mg (dos cápsulas de 50 mg) una vez al día.
No se recomienda la administración de encorafenib a una dosis de 450 mg una vez al día en monoterapia. Si se interrumpe de manera temporal la administración de binimetinib, se debe reducir la dosis de encorafenib a 300 mg una vez al día mientras dure la interrupción de binimetinib (ver sección 4.2 de la Ficha Técnica de binimetinib), ya que encorafenib no se tolera bien a la dosis de 450 mg en monoterapia. Si se suspende de forma permanente la administración de binimetinib, se debe suspender el tratamiento con encorafenib.
Si se interrumpe de manera temporal la administración de encorafenib (ver tablas 3 y 4), se debe interrumpir también la de binimetinib. Si se suspende de forma permanente la administración de encorafenib, se debe suspender también la de binimetinib.
Si se produce toxicidad relacionada con el tratamiento, entonces la dosis de encorafenib y binimetinib se debe reducir, interrumpir o suspender. Las modificaciones de dosis son necesarias solo para binimetinib (reacciones adversas relacionadas principalmente con binimetinib) para lo siguiente: el desprendimiento del epitelio pigmentario retiniano (DEPR), la oclusión venosa retiniana (OVR), la enfermedad pulmonar intersticial/neumonitis, la disfunción cardíaca, el aumento de la creatinfosfoquinasa (CK, por sus siglas en inglés) y la rabdomiolisis, y el tromboembolismo venoso (TEV).
Si se produce una de estas toxicidades, ver sección 4.2 de la ficha técnica de binimetinib para obtener instrucciones sobre la modificación de la dosis de binimetinib.
Cáncer colorrectal
El manejo de las reacciones adversas puede requerir reducir la dosis, interrumpir temporalmente la administración o suspender el tratamiento de encorafenib (ver las tablas 2, 3 y 4).
Para obtener información sobre la posología y las modificaciones de dosis recomendadas de cetuximab, consulte la sección 4.2 de la Ficha Técnica de cetuximab.
En la tabla 2 se indican las recomendaciones para la reducción de la dosis de encorafenib.
Tabla 2: Modificaciones de dosis recomendadas para encorafenib cuando se utiliza en combinación con cetuximab en la indicación de CCRm
Nivel de dosis Dosis de encorafenib cuando se utiliza en combinación con cetuximab
Dosis inicial Cuatro cápsulas de 75 mg (300 mg) una vez al día 1ª reducción de la dosis Tres cápsulas de 75 mg (225 mg) una vez al día 2ª reducción de la dosis Dos cápsulas de 75 mg (150 mg) una vez al día Si se suspende de forma permanente la administración de encorafenib, se debe suspender también la de cetuximab.
Si se suspende de forma permanente la administración de cetuximab, se debe suspender también la de encorafenib.
Melanoma y cáncer colorrectal
Las modificaciones de dosis en caso de reacciones adversas se indican a continuación y en las tablas 3 y 4.
Para nuevas neoplasias malignas cutáneas primarias: No es necesario modificar la dosis de encorafenib.
Para nuevas neoplasias malignas no cutáneas primarias positivas para la mutación de RAS: se debe considerar suspender el tratamiento con encorafenib de forma permanente.
Tabla 3: Modificaciones de dosis recomendadas para encorafenib cuando se utiliza en combinación con binimetinib o en combinación con cetuximab para determinadas reacciones adversas
Grado de la reacción adversaa Encorafenib Reacciones cutáneas · Grado 2 Se debe continuar con encorafenib. Si la erupción empeora o no mejora en el plazo de 2 semanas de tratamiento, se debe suspender la administración de encorafenib hasta que mejore a Grado 0 o 1 y, después, reanudarla a la misma dosis.
· Grado 3 Se debe suspender la administración de encorafenib hasta que mejore a Grado 0 o 1 y reanudarla a la misma dosis en caso de ser el primer acontecimiento, o reanudarla a una dosis reducida si es de Grado 3 recurrente. · Grado 4 Se debe suspender de forma permanente el tratamiento con encorafenib. Síndrome de eritrodisestesia palmoplantar (EPP) · Grado 2 Se debe continuar la administración de encorafenib e instaurar medidas de soporte tales como tratamientos tópicos. Si, a pesar del tratamiento de soporte, no mejora en 2 semanas, se debe suspender la administración de encorafenib hasta que mejore a Grado 0 o 1 y reanudarse a la misma dosis o a una dosis reducida.
· Grado 3 Se debe suspender la administración de encorafenib, instaurar medidas de soporte tales como tratamientos tópicos, y se debe examinar al paciente semanalmente. Encorafenib se debe reanudar a la misma dosis o a una dosis reducida cuando mejore a Grado 0 o 1.
Uveítis, incluidas iritis e iridociclitis · Grado 1-3 En caso de uveítis de Grado 1 o 2 que no responde a tratamiento ocular específico (p. ej., tópico) o de uveítis de Grado 3, se debe suspender la administración de encorafenib y repetirse el control oftalmológico a las 2 semanas. · Si la uveítis es de Grado 1 y mejora a Grado 0, se debe reanudar el tratamiento a la misma dosis.
· Si la uveítis es de Grado 2 o 3 y mejora a Grado 0 o 1, se debe reanudar el tratamiento a dosis reducida.
· Si no mejora en 6 semanas, se debe repetir el control oftalmológico, y suspender de forma permanente el tratamiento con encorafenib.
Se debe suspender de forma permanente el tratamiento con encorafenib y realizar un seguimiento con control oftalmológico. Prolongación del intervalo QTc · QTcF >500 ms con una variación ≤60 ms respecto al valor previo al tratamiento. Se debe suspender la administración de encorafenib (ver seguimiento en sección 4.4). Se debe reanudar el tratamiento con encorafenib a dosis reducida cuando el QTcF sea ≤500 ms.
Se debe suspender la administración de encorafenib si se produce más de una recaída.
· QTcF >500 ms con un aumento >60 ms respecto al valor previo al tratamiento Se debe suspender de forma permanente el tratamiento con encorafenib (ver seguimiento en sección 4.4). Anomalías de las analíticas hepáticas Se debe continuar con encorafenib. · Si no se produce mejoría en 4 semanas, se debe suspender la administración de encorafenib hasta que mejore a Grado 0 o 1 o a los valores iniciales o previos al tratamiento y, después, reanudarse el tratamiento a la misma dosis.
Se debe suspender la administración de encorafenib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales,
se debe reanudar el tratamiento a dosis reducida.
· Si no mejora, se debe suspender de forma permanente el tratamiento con encorafenib.
Se debe suspender la administración de encorafenib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanuda el tratamiento a dosis reducida.
· Si no mejora, se debe suspender de forma permanente el tratamiento con encorafenib.
O bien se debe suspender de forma permanente el tratamiento con encorafenib.
Se debe considerar suspender de forma permanente el tratamiento con encorafenib. Se debe suspender de forma permanente el tratamiento con encorafenib. a Criterios Terminológicos Comunes para Acontecimientos Adversos del Instituto Nacional del Cáncer de los Estados Unidos (NCI CTCAE, por sus siglas en inglés) versión 4.03
Tabla 4: Modificaciones de dosis recomendadas de encorafenib cuando se utiliza en combinación con binimetinib o en combinación con cetuximab para otras reacciones adversas
Grado de la reacción adversa Encorafenib · Reacciones adversas recurrentes o intolerables de Grado 2 · Primer acontecimiento de reacciones adversas de Grado 3
Se debe suspender la administración de encorafenib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales,
se debe reanudar el tratamiento a dosis reducida.
· Si no mejora, se debe suspender de forma permanente el tratamiento con encorafenib.
· Primer acontecimiento de cualquier reacción adversa de Grado 4 Se debe suspender la administración de encorafenib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanudar el tratamiento a dosis reducida.
· Si no mejora, se debe suspender de forma permanente el tratamiento con encorafenib.
O bien se debe suspender de forma permanente el tratamiento con encorafenib.
· Reacciones adversas recurrentes de Grado 3 Se debe considerar suspender de forma permanente el tratamiento con encorafenib. · Reacciones adversas recurrentes de Grado 4 Se debe suspender de forma permanente el tratamiento con encorafenib. Duración del tratamiento
El tratamiento se continuará hasta que el paciente deje de obtener beneficio del mismo o hasta la aparición de toxicidad inaceptable.
Dosis olvidadas
Si el paciente olvida tomar una dosis de encorafenib, solo debe tomar la dosis olvidada en caso de que falten más de 12 horas hasta la siguiente dosis programada.
Vómitos
Si el paciente sufre vómitos tras la administración de encorafenib, no debe tomar una dosis adicional, sino esperar hasta la siguiente dosis programada.
Poblaciones especiales
Pacientes de edad avanzada
No son necesarios ajustes de la dosis para pacientes mayores de 65 años (ver sección 5.2).
Insuficiencia hepática
Los pacientes con insuficiencia hepática de leve a grave pueden presentar una mayor exposición a encorafenib (ver sección 5.2).
Se debe administrar encorafenib con precaución a dosis de 300 mg una vez al día en pacientes con insuficiencia hepática leve (Child-Pugh clase A).
No se puede hacer una recomendación posológica en pacientes con insuficiencia hepática moderada (Child-Pugh clase B) o grave (Child-Pugh clase C).
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal leve a moderada, según un análisis farmacocinético (FC) poblacional. No hay datos clínicos sobre el uso de encorafenib en pacientes con insuficiencia renal grave. Por consiguiente, no se puede determinar la posible necesidad de un ajuste de dosis. Encorafenib se debe utilizar con precaución en pacientes con insuficiencia renal grave (ver las secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de encorafenib en niños y adolescentes. No se dispone de datos.
Forma de administración
Braftovi se toma vía oral. Las cápsulas deben tragarse enteras con agua. Pueden tomarse con o sin alimentos. Se debe evitar la administración de encorafenib con zumo de pomelo (ver las secciones 4.4 y 4.5)
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Encorafenib se debe administrar en combinación con binimetinib (para pacientes con melanoma no resecable o metastásico con mutación BRAF V600), o en combinación con cetuximab (para pacientes con cáncer colorrectal metastásico con mutación BRAF V600E). Para obtener más información sobre las advertencias y precauciones relativas al tratamiento con binimetinib o cetuximab, ver sección 4.4 de la ficha técnica de binimetinib o de la ficha técnica de cetuximab.
Prueba de la mutación del gen BRAF
Antes de iniciar el tratamiento con encorafenib, se debe confirmar que los pacientes presentan melanoma no resecable o metastásico con mutación BRAF V600 o cáncer colorrectal metastásico con mutación BRAF V600E mediante una prueba validada. La eficacia y seguridad de encorafenib solo se ha establecido en pacientes con tumores de melanoma que expresan las mutaciones BRAF V600E y V600K o tumores de colorrectal que expresan la mutación BRAF V600E. Encorafenib no se debe utilizar en pacientes con melanoma maligno sin mutación de BRAF o cáncer colorrectal sin mutación de BRAF.
Encorafenib combinado con binimetinib en pacientes cuya enfermedad ha progresado a un inhibidor del gen BRAF
Hay datos limitados relativos al uso de la combinación de encorafenib con binimetinib en pacientes cuya enfermedad ha progresado a un inhibidor de BRAF previo administrado para el tratamiento de melanoma no resecable o metastásico con mutación BRAF V600. Estos datos muestran que la eficacia de la combinación sería menor en estos pacientes.
Encorafenib combinado con binimetinib en pacientes con metástasis cerebrales
Hay datos sobre eficacia limitados relativos a la combinación de encorafenib y binimetinib en pacientes con melanoma con mutación BRAF V600 que presentan metástasis cerebrales (ver sección 5.1).
Disfunción del ventrículo izquierdo (DVI)
Se ha notificado DVI, definida como una disminución sintomática o asintomática de la fracción de eyección, cuando se administra encorafenib en combinación con binimetinib.
Se recomienda evaluar la fracción de eyección del ventrículo izquierdo (FEVI) mediante ecocardiograma o ventriculografía con radionúclidos (MUGA) antes de comenzar el tratamiento con encorafenib y binimetinib, un mes después del inicio y luego cada 3 tres meses aproximadamente, o con más frecuencia si está clínicamente indicado, mientras dure el tratamiento. Si durante el tratamiento se produce DVI, ver sección 4.2 de la ficha técnica de binimetinib.
No se ha establecido la seguridad de encorafenib en combinación con binimetinib en pacientes con una FEVI basal por debajo del 50 % o bien por debajo del límite inferior normal institucional. Por consiguiente, binimetinib se debe utilizar con precaución en estos pacientes; se suspenderá el tratamiento con binimetinib y encorafenib ante una disfunción sintomática del ventrículo izquierdo, una disminución de la FEVI de Grado 3 o 4 o un descenso absoluto de la FEVI ≥ 10% respecto al valor inicial, y se evaluará la FEVI cada 2 semanas hasta la recuperación.
Hemorragia
La administración de encorafenib puede provocar hemorragias, incluidos acontecimientos hemorrágicos mayores (ver sección 4.8). El riesgo de hemorragia puede incrementarse con el uso concomitante de tratamientos anticoagulantes y antiagregantes plaquetarios. Los acontecimientos hemorrágicos de Grado ≥3 se deben tratar mediante la interrupción de la administración de la dosis o la suspensión del tratamiento (ver tabla 4 en la sección 4.2) y como esté clínicamente indicado.
Toxicidad ocular
La administración de encorafenib puede provocar reacciones adversas oculares como uveítis, iritis e iridociclitis. Se ha notificado también DEPR en pacientes tratados con encorafenib en combinación con binimetinib (ver sección 4.8).
Los pacientes deben ser evaluados en cada visita para detectar síntomas de posibles trastornos visuales nuevos o un empeoramiento de los ya existentes. Si se identifican síntomas de trastornos visuales nuevos o un empeoramiento de los ya existentes, como una disminución de la visión central, visión borrosa o la pérdida de visión, se recomienda realizar rápidamente una exploración oftalmológica.
En caso de que se produzca un acontecimiento de uveítis, iridociclitis o iritis, durante el tratamiento, ver sección 4.2.Si, durante el tratamiento, el paciente presenta DEPR u OVR, ver sección 4.2 de la ficha técnica de binimetinib para obtener orientación.
Prolongación del intervalo QT
Se ha observado la prolongación del intervalo QT en pacientes tratados con inhibidores de BRAF. No se ha realizado ningún estudio exhaustivo para evaluar el potencial de prolongación del intervalo QT de encorafenib.
En general, los resultados del tratamiento con encorafenib en monoterapia indican que el fármaco puede provocar un leve aumento del ritmo cardiaco. Los resultados agrupados de los estudios de combinación de encorafenib con binimetinib a las dosis recomendadas, así como un estudio de encorafenib en monoterapia, indican que el fármaco puede provocar un ligero aumento del intervalo QTc (ver sección 5.1).
No hay datos suficientes para excluir una exposición clínicamente significativa dependiente de la prolongación del intervalo QT.
Debido al posible riesgo de prolongación del intervalo QTc, se recomienda corregir las anomalías electrolíticas en suero, incluidos los niveles de magnesio y potasio, y controlar los factores de riesgo de prolongación del intervalo QTc (p. ej., insuficiencia cardiaca congestiva, bradiarritmias) antes de comenzar el tratamiento y durante el tratamiento.
Se recomienda realizar un electrocardiograma (ECG) antes de comenzar el tratamiento con encorafenib, un mes después del inicio y luego cada 3 tres meses aproximadamente, o con más frecuencia si está clínicamente indicado, mientras dure el tratamiento. Si se produce una prolongación del intervalo QTc, se puede manejar con una reducción de la dosis, la interrupción o la suspensión del tratamiento, la corrección de las anomalías electrolíticas y el control de los factores de riesgo (ver sección 4.2).
Nuevas neoplasias malignas primarias
Se han observado nuevas neoplasias malignas primarias, cutáneas y no cutáneas, en pacientes tratados con inhibidores de BRAF, las cuales también se pueden producir cuando se administra encorafenib (ver sección 4.8).
Neoplasias malignas cutáneas
En pacientes tratados con inhibidores de BRAF, como encorafenib, se han observado neoplasias malignas cutáneas como el carcinoma de células escamosas de la piel (CCEP), incluido el queratoacantoma.
Se han observado nuevos melanomas primarios en pacientes tratados con inhibidores de BRAF, como encorafenib (ver sección 4.8).
Se debe realizar una evaluación dermatológica previa al inicio del tratamiento con encorafenib, cada 2 meses mientras dure el tratamiento y hasta 6 meses después de la suspensión del tratamiento. Las lesiones sospechosas se deben tratar mediante resección dermatológica y evaluación anatomopatológica. Se debe indicar a los pacientes que informen inmediatamente al médico si observan cualquier lesión cutánea nueva. El tratamiento con encorafenib debe continuar sin ninguna modificación de la dosis.
Neoplasias malignas no cutáneas
Teniendo en cuenta su mecanismo de acción, encorafenib puede promover el desarrollo de neoplasias malignas relacionadas con la activación del oncogen RAS por mutación u otros mecanismos. Los pacientes que reciben encorafenib se deben someter a una exploración de cabeza y cuello, una tomografía computarizada (TC) de tórax/abdomen, exámenes anales, y pélvicos (en el caso de las mujeres) y hemograma completo, antes del inicio, durante y al final del tratamiento, cuando esté clínicamente indicado. Se debe considerar la suspensión permanente del tratamiento con encorafenib en pacientes que desarrollen neoplasias malignas no cutáneas positivas para mutaciones de RAS. Se debe evaluar con precaución la relación beneficio-riesgo antes de administrar encorafenib a pacientes con un cáncer previo o simultáneo relacionado con una mutación de RAS.Anomalías de las analíticas hepáticas
Insuficiencia hepática
Dado que encorafenib se metaboliza y elimina principalmente por vía hepática, los pacientes con insuficiencia hepática de leve a grave pueden ver aumentada su exposición al fármaco por encima del intervalo de exposición de variabilidad interindividual (ver sección 5.2).
En ausencia de datos clínicos, no se recomienda encorafenib en pacientes con insuficiencia hepática moderada o grave.
Encorafenib se debe administrar con precaución en dosis de 300 mg una vez al día en pacientes con insuficiencia hepática leve (ver sección 4.2).
Se recomienda un control más exhaustivo de las toxicidades relacionadas con encorafenib en pacientes con insuficiencia hepática leve, que incluya reconocimiento clínico y pruebas de función hepática y realizar ECG cuando esté clínicamente indicado, durante el tratamiento.
Insuficiencia renal
No hay datos disponibles de pacientes con insuficiencia renal grave (ver las secciones 4.2 y 5.2).
Encorafenib se debe utilizar con precaución en pacientes con insuficiencia renal grave. Se han notificado con frecuencia elevaciones de la creatinina durante el tratamiento con encorafenib en monoterapia o combinado con binimetinib o cetuximab. Los casos observados de fallo renal, como lesión renal aguda e insuficiencia renal, en general se asociaron a vómitos y deshidratación. Otros factores que contribuyen son la diabetes y la hipertensión. Se debe vigilar la creatinina en sangre cuando esté clínicamente indicado, y controlarse la elevación de la creatinina mediante modificaciones de la dosis o suspensión del tratamiento (ver tabla 4 en la sección 4.2). Los pacientes se deben asegurar de realizar una ingesta adecuada de líquidos durante el tratamiento.
Efectos de otros medicamentos sobre encorafenib
Se debe evitar el uso de inhibidores potentes del CYP3A durante el tratamiento con encorafenib. Si es necesario el uso concomitante de inhibidores potentes del CYP3A, por seguridad se debe controlar de forma atenta a los pacientes (ver sección 4.5).
Se debe tener precaución si se administran de forma concomitante inhibidores moderados del CYP3A con encorafenib.
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre encorafenib
Encorafenib se metaboliza principalmente por la CYP3A4.
Inhibidores de la CYP3A4
La administración concomitante de inhibidores moderados (diltiazem) y potentes (posaconazol) de la CYP3A4 con dosis únicas de encorafenib en voluntarios sanos provocó un incremento de 2 y 3 veces del área bajo la curva de concentración-tiempo (AUC), respectivamente, y un aumento del 44,6% y 68,3% en la concentración máxima de encorafenib (Cmáx), respectivamente.
Las predicciones basadas en modelos indican que el efecto de posaconazol tras la administración repetida puede ser similar para el AUC (aumento de 3 veces) y ligeramente mayor para la Cmáx (aumento de 2,7 veces). Las predicciones basadas en modelos para ketoconazol sugieren un incremento de 5 veces para el AUC, aproximadamente, y de 3 a 4 veces para la Cmáx de encorafenib después de la administración de encorafenib 450 y 300 mg CD, respectivamente.
Por consiguiente, se debe evitar la administración concomitante de encorafenib con inhibidores potentes de la CYP3A4 (debido al aumento de la exposición a encorafenib y el posible incremento de la toxicidad; ver sección 5.2). Algunos ejemplos de inhibidores potentes de la CYP3A4 incluyen, pero no se limitan a, ritonavir, itraconazol, claritromicina, telitromicina, posaconazol y el zumo de pomelo. Si es inevitable el uso concomitante de inhibidores potentes del sistema enzimático CYP3A, por seguridad se debe controlar de manera atenta a los pacientes.
La administración concomitante de inhibidores moderados de la CYP3A4 debe hacerse con precaución. Algunos ejemplos de inhibidores moderados de la CYP3A4 son, entre otros: amiodarona, eritromicina, fluconazol, diltiazem, amprenavir e imatinib. Cuando se administra de forma concomitante encorafenib con un inhibidor moderado del CYP3A, por seguridad se debe controlar de manera atenta a los pacientes.
Inductores de la CYP3A4
La administración concomitante de encorafenib con un inductor potente de la CYP3A4 no se ha evaluado en ningún estudio clínico; sin embargo, es probable que la exposición a encorafenib se vea reducida y, por consiguiente, la eficacia de encorafenib puede resultar comprometida. Algunos ejemplos de inductores potentes de la CYP3A4 incluyen, pero no se limitan a, carbamazepina, rifampicina, fenitoína e hipérico (hierba de San Juan). Se debe considerar el uso de fármacos alternativos sin capacidad o con una capacidad moderada de inducir el CYP3A.
Efectos de encorafenib sobre otros medicamentos
Sustratos del CYP
Encorafenib es un potente inductor de la CYP3A4. El uso concomitante con fármacos que sean sustratos de la CYP3A4 (p. ej., anticonceptivos hormonales) puede restar eficacia a estos fármacos. Si no se puede evitar la coadministración de sustratos de CYP3A4 de índice terapéutico estrecho, ajuste la dosis de estos sustratos de acuerdo con su Ficha Técnica aprobada.
Encorafenib es un inhibidor de la UGT1A1. El uso concomitante de fármacos que sean sustratos de la UGT1A1 (p. ej., raltegravir, atorvastatina y dolutegravir) puede aumentar su exposición y, por consiguiente, se deben administrar con precaución.
Efecto de encorafenib sobre binimetinib
Aunque encorafenib es un inhibidor reversible relativamente potente de la UGT1A1, no se han observado diferencias clínicas en la exposición a binimetinib cuando este se administra de forma concomitante con encorafenib.
Sustratos transportadores
In vivo, encorafenib es un inhibidor de OATP1B1, OATP1B3 y/o BCRP. La coadministración de encorafenib con sustratos de OATP1B1, OATP1B3 o BCRP (como rosuvastatina, atorvastatina, metotrexato) puede producir un aumento de las concentraciones (ver sección 5.2).
In vitro, encorafenib es un inhibidor potencial de cierto número de otros transportadores. Los fármacos que son sustratos de los transportadores renales OAT1, OAT3, OCT2 (como furosemida o penicilina) o sustratos de los transportadores hepáticos OCT1 (como bosentan) o sustratos de P-gp (p. ej., posaconazol) también pueden ver aumentada su exposición.
Por consiguiente, estos fármacos, sustratos de transportadores, se deben administrar con precaución.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/anticoncepción femenina
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con encorafenib y hasta 1 mes después de la última dosis. Encorafenib puede disminuir la eficacia de los anticonceptivos hormonales (ver sección 4.5). Por lo tanto, las pacientes que utilicen anticoncepción hormonal deben usar un método adicional o alternativo, como un método de barrera (p. ej., preservativo), durante el tratamiento con encorafenib y hasta 1 mes como mínimo tras finalizar el tratamiento.
Embarazo
No hay datos relativos al uso de encorafenib en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
No se recomienda utilizar encorafenib durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos. Si la paciente utiliza encorafenib durante el embarazo o se queda embarazada durante el tratamiento, debe ser informada de los daños potenciales para el feto.
Lactancia
Se desconoce si encorafenib o sus metabolitos se excretan en la leche materna. No se puede excluir el riesgo en recién nacidos/niños lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con encorafenib tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
No existen datos relativos a los efectos de encorafenib sobre la fertilidad en humanos. En los estudios con animales se ha visto que el uso de encorafenib puede afectar a la fertilidad de los machos con capacidad reproductiva (ver sección 5.3). Puesto que se desconoce la relevancia clínica de estas observaciones, se debe informar a los pacientes del posible riesgo para la espermatogénesis.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de encorafenib sobre la capacidad para conducir y utilizar máquinas es pequeña. Se han notificado alteraciones visuales en algunos pacientes tratados con encorafenib durante los estudios clínicos. Se debe indicar a los pacientes que no conduzcan ni utilicen máquinas si sufren alteraciones visuales o cualquier otra reacción adversa que pueda afectar a su capacidad para conducir y utilizar máquinas (ver las secciones 4.4 y 4.8).
4.8 Reacciones adversas
Resumen del perfil de seguridad
La seguridad de encorafenib (450 mg una vez al día por vía oral) en combinación con binimetinib (45 mg dos veces al día por vía oral) se evaluó en 274 pacientes con melanoma no resecable o metastásico y mutación BRAF V600 (en adelante, «población global con Combo 450»), en dos estudios de fase II (CMEK162X2110 y CLGX818X2109) y un estudio de fase III (CMEK162B2301, Parte 1). A la dosis recomendada (n = 274) en pacientes con melanoma no resecable o metastásico, las reacciones adversas más frecuentes (>25 %) en los pacientes tratados con encorafenib junto con binimetinib fueron: fatiga, náuseas, diarrea, vómitos, desprendimiento de retina, dolor abdominal, artralgia, elevación de la CK en sangre y mialgias.
La seguridad de encorafenib (300 mg una vez al día por vía oral) en combinación con binimetinib (45 mg dos veces al día por vía oral) se evaluó en 257 pacientes con melanoma no resecable o metastásico y mutación BRAF V600 (en adelante, «población global con Combo 300»), en el estudio de fase III (CMEK162B2301, Parte 2). Las reacciones adversas más frecuentes (>25%) en los pacientes tratados con encorafenib 300 mg administrado junto con binimetinib fueron fatiga, náuseas y diarrea.
El perfil de seguridad de encorafenib en monoterapia (300 mg una vez al día por vía oral) se basa en los datos de 217 pacientes con melanoma no resecable o metastásico y mutación BRAF V600 (en adelante, «población global de encorafenib 300»). Las reacciones adversas medicamentosas (RAM) notificadas con más frecuencia (>25 %) con encorafenib 300 fueron: hiperqueratosis, alopecia, EPP, fatiga, erupción, artralgia, piel seca, náuseas, mialgias, cefalea, vómitos y prurito.
La seguridad de encorafenib (300 mg una vez al día por vía oral) en combinación con cetuximab (dosificado según su ficha técnica) se evaluó en 216 pacientes con cáncer colorrectal metastásico con mutación BRAF V600E, basado en el estudio de fase III ARRAY-818-302. Las reacciones adversas más frecuentes (>25%) notificadas en esta población fueron: fatiga, náuseas, diarrea, dermatitis acneiforme, dolor abdominal, artralgia / dolor musculoesquelético, disminución del apetito, erupción cutánea y vómitos.
La tasa de interrupción de todos los fármacos del estudio debido a cualquier reacción adversa fue del 1,9% en pacientes tratados con encorafenib 300 mg en combinación con cetuximab.
Tabla de reacciones adversas
Las reacciones adversas se presentan a continuación de acuerdo con la clasificación de órganos del sistema MedDRA y de acuerdo con su frecuencia, mediante la siguiente convención: muy frecuentes (≥1/10), frecuentes (de ≥1/100 a <1/10), poco frecuentes (de ≥1/1 000 a <1/100), raras (de ³1/10 000 a <1/1 000), muy raras (<1/10 000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad, dentro de cada intervalo de frecuencia.
Tabla 5: Reacciones adversas
Frecuencia Encorafenib 300 mg en monoterapia (n = 217) Encorafenib 450 mg en combinación con binimetinib (n = 274) Encorafenib 300 mg en combinación con cetuximab (n = 216) Neoplasias benignas, malignas y no especificadas Muy frecuentes Papiloma de piel* Nevus melanocítico
Nevus melanocítico Frecuentes CCEP a Nuevo melanoma primario*
CCEP a Carcinoma basocelular*
Papiloma de piel*
CCEP a Papiloma de piel*
Nuevo melanoma primario*
Poco frecuentes Carcinoma basocelular Carcinoma basocelular Trastornos de la sangre y del sistema linfático Muy frecuentes Anemia Trastornos del sistema inmunológico Frecuentes Hipersensibilidadb Hipersensibilidadb Hipersensibilidadb Trastornos del metabolismo y de la nutrición Muy frecuentes Apetito disminuido Apetito disminuido Trastornos psiquiátricos Muy frecuentes Insomnio Insomnio Trastornos del sistema nervioso Muy frecuentes Cefalea* Neuropatía periférica*
Disgeusia*
Neuropatía periférica* Mareos*
Cefalea *
Neuropatía periférica* Cefalea*
Frecuentes Paresis facialc Disgeusia* Mareos* Disgeusia
Poco frecuentes Paresis facialc Trastornos oculares Muy frecuentes Alteración visual* DEPR*
Frecuentes Uveítis* Poco frecuentes Uveítis* Trastornos cardiacos Frecuentes Taquicardia supraventriculard DVIh Taquicardia supraventriculard Trastornos vasculares Muy frecuentes Hemorragiai Hipertensión*
Hemorragiai Frecuentes TEVj Trastornos gastrointestinales Muy frecuentes Náuseas Vómitos*
Estreñimiento
Náuseas Vómitos*
Estreñimiento
Dolor abdominal*
Diarrea*
Náuseas Vómitos
Estreñimiento
Dolor abdominal*
Diarrea*
Frecuentes Colitisk Poco frecuentes Pancreatitis* Pancreatitis* Pancreatitis* Trastornos de la piel y del tejido subcutáneo Muy frecuentes EPP Hiperqueratosis*
Erupción*
Piel seca*
Prurito*
Alopecia*
Eritemae
Hiperpigmentación de la piel*
Hiperqueratosis* Erupción*
Piel seca*
Prurito*
Alopecia*
Dermatitis acneiforme* Erupción*
Piel seca*
Prurito*
Frecuentes Dermatitis acneiforme* Exfoliación de la pielf
Fotosensibilidad*
Dermatitis acneiforme* EPP
Eritema*
Paniculitis*
Fotosensibilidad*
Hiperpigmentación de la piel EPP
Hiperqueratosis*
Alopecia
Eritema e
Poco frecuentes Exfoliación de la pielf Trastornos musculoesqueléticos y del tejido conjuntivo Muy frecuentes Artralgia* Mialgiag
Dolor en las extremidades
Dolor de espalda
Artralgia* Trastornos musculares/mialgial
Dolor en las extremidades
Dolor de espalda
Artralgia/ Dolor musculoesquelético* Miopatía/ Trastornos musculares*
Dolor en las extremidades
Dolor de espalda
Frecuentes Artritis* Poco frecuentes Rabdomiolisis Trastornos renales y urinarios Frecuentes Fallo renal* Fallo renal* Fallo renal* Trastornos generales y alteraciones en el lugar de administración Muy frecuentes Fatiga* Pirexia*
Fatiga* Pirexia*
Edema periféricom
Fatiga* Pirexia*
Exploraciones complementarias Muy frecuentes γ-glutamil transferasa (GGT) elevada * Creatinfosfoquinasa en sangre elevada γ-glutamil transferasa (GGT) elevada *
Transaminasas elevada *
Frecuentes Transaminasas elevadas* Creatinina en sangre elevada*
Lipasa elevada
Fosfatasa alcalina (FA) en sangre Creatinina en sangre elevada *
Amilasa elevada
Lipasa elevada
Creatinina en sangre elevada * Transaminasas elevadas*
Poco frecuentes Amilasa elevada Amilasa elevada Lipasa elevada
* términos compuestos que incluyen más de un término preferente.
a incluye, pero no limitado a, queratoacantoma y carcinoma de células escamosas.
b incluye, pero no limitado a, angioedema, hipersensibilidad a fármacos, hipersensibilidad, vasculitis por hipersensibilidad, urticaria y reacción anafiláctica.
c incluye trastorno del nervio facial, parálisis facial y paresis facial.
d incluye, pero no limitado a, extrasístoles y taquicardia sinusal.
e incluye eritema, eritema generalizado y eritema plantar.
f incluye dermatitis exfoliativa, exfoliación de la piel y erupción exfoliativa.
g incluye mialgia, fatiga muscular, lesión muscular, espasmo muscular y debilidad muscular.
h incluye disfunción del ventrículo izquierdo, disminución de la fracción de eyección, insuficiencia cardíaca y fracción de eyección anómala.
i incluye hemorragia en distintos órganos, como hemorragia cerebral.
j incluye, pero no limitado a, embolia pulmonar, trombosis venosa profunda, embolia, tromboflebitis, tromboflebitis superficial y trombosis.
k incluye colitis, colitis ulcerosa, enterocolitis y proctitis.
l incluye mialgia, debilidad muscular, espasmo muscular, lesión muscular, miopatía y miositis.
m incluye, pero no limitado a, retención de líquidos, edema periférico y edema localizado.
Cuando encorafenib se utilizó a una dosis de 300 mg una vez al día en combinación con binimetinib 45 mg dos veces al día (Combo 300) en el estudio CMEK162B2301-Parte 2, la frecuencia fue inferior comparado con la población global con Combo 450 para las siguientes reacciones adversas: anemia, neuropatía periférica, hemorragia, hipertensión, prurito (frecuente); y colitis, amilasa elevada y lipasa elevada (poco frecuente).
Descripción de determinadas reacciones adversas
Neoplasias malignas cutáneas
Carcinoma de células escamosas de la piel
Melanoma
En la población global con Combo 450, se observaron CCEP, incluyendo queratoacantomas, en el 3,3% (9/274) de los pacientes. La mediana del tiempo hasta la aparición del primer acontecimiento de CCEP (de cualquier grado) fue de 6,5 meses (intervalo de 1,0 a 22,8 meses).
En la población global de encorafenib 300, se notificaron CCEP en el 7,4% (16/217) de los pacientes. En el caso de los pacientes del estudio de fase III (CMEK162B2301) que desarrollaron CCEP, la mediana del tiempo hasta la aparición del primer acontecimiento (de cualquier Grado) fue de 2,3 meses (intervalo de 0,3 a 12,0 meses).
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se observó CCEP, incluido el queratoacantoma, en el 1,4% (3/216) de los pacientes. Los tiempos para el primer evento de CCEP (de cualquier grado) fueron de 0,5, 0,6 y 3,6 meses para estos 3 pacientes.
Nuevo melanoma primario
Melanoma
En la población global de encorafenib 300, se produjeron acontecimientos de nuevo melanoma primario en el 4,1% (9/217) de los pacientes, notificado como de Grado 1 en el 1,4% (3/217) de los pacientes, de Grado 2 en el 2,1% (4/217) de los pacientes, de Grado 3 en el 0,5% (1/217) de los pacientes y de Grado 4 en el 0,5% (1/217) de los pacientes.
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se produjeron acontecimientos de nuevo melanoma primario en el 1,9% (4/216) de los pacientes, notificado como de Grado 2 en el 0,9% (2/216) de los pacientes y de Grado 3 en el 0,9% (2/216) de los pacientes.
Acontecimientos oculares
Melanoma
En la población global con Combo 450, se notificó uveítis en el 4,4% (12/274) de los pacientes, siendo de Grado 1 en el 0,4% (1/274) de los pacientes, de Grado 2 en el 3,6% (10/274) de los pacientes y de Grado 3 en el 0,4% (1/274) de los pacientes. Se notificó alteración visual, como visión borrosa y disminución de la agudeza visual, en el 21,5% (59/274) de los pacientes. La uveítis y la alteración visual fueron por lo general reversibles.
Se produjo DEPR en el 29,6% (81/274) de los pacientes, la mayoría de ellos presentaron Grado 1-2 y un 1,8% (5/274) presentaron Grado 3.
En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó DEPR en el 12,5% (32/257) de los pacientes, con Grado 4 en el 0,4% (1/257) de los pacientes.
Disfunción del ventrículo izquierdo
Se notificó DVI cuando se administró encorafenib en combinación con binimetinib en pacientes con melanoma (ver sección 4.8 de la ficha técnica de binimetinib).
Hemorragia
Melanoma
Se notificó hipertensión cuando se administró encorafenib en combinación con binimetinib en pacientes con melanoma (ver sección 4.8 de la ficha técnica de binimetinib).
Tromboembolismo venoso
Se notificó TEV cuando se administró encorafenib en combinación con binimetinib en pacientes con melanoma (ver sección 4.8 de la ficha técnica de binimetinib).
Pancreatitis
Melanoma
En la población global con Combo 450, se observó elevación de las enzimas pancreáticas, la mayoría de las veces asintomática. Se notificaron elevaciones de la amilasa y la lipasa en el 3,3% (9/274) y el 5,1% (14/274) de los pacientes, respectivamente. Se notificó pancreatitis en el 0,7% (2/274) de los pacientes. Ambos pacientes sufrieron acontecimientos de Grado 3. La pancreatitis obligó a interrumpir la administración del fármaco en el 0,4% (1/274) de los pacientes.
Cáncer colorrectal
En la población tratada con encorafenib 300 mg en combinación con cetuximab, se notificó pancreatitis de Grado 3 con elevaciones de la lipasa y la amilasa en 1 paciente (0,5%) y condujo a la interrupción de la dosis.
Reacciones dermatológicas
Erupción
Melanoma
En la población global con Combo 450, se produjo erupción en el 19,7% (54/274) de los pacientes. La mayoría de los casos fueron leves, y se notificaron acontecimientos de Grado 3 o 4 en el 0,7% (2/274) de los pacientes. El exantema obligó a suspender el tratamiento en el 0,4% (1/274) de los pacientes, y a interrumpir la administración del fármaco o modificar la dosis en el 1,1% (3/274) de los pacientes.
En la población conjunta de encorafenib 300, se notificó erupción en el 43,3% (94/217) de los pacientes. La mayoría de los casos fueron leves, y se notificaron acontecimientos de Grado 3 o 4 en el 4,6% (10/217) de los pacientes. La erupción obligó a suspender el tratamiento en el 0,5% (1/217) de los pacientes y a interrumpir la administración del fármaco o modificar la dosis en el 7,4% (16/217) de los pacientes.
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se produjo erupción en el 30,6% (66/216) de los pacientes. La mayoría de los acontecimientos fueron leves, y se notificaron acontecimientos de Grado 3 en el 0,5% (1/216) de los pacientes. La erupción provocó la interrupción de la dosis en 0,5% (1/216) de los pacientes.
Síndrome de eritrodisestesia palmoplantar (EPP)
Melanoma
Se notificó EPP en el 6,2% (17/274) de los pacientes en la población global con Combo 450. Todas las reacciones adversas de EPP fueron de Grado 1 (3,3%) o Grado 2 (2,9%). Se tuvo que interrumpir o modificar la dosis en el 1,1% (3/274) de los pacientes.
En el grupo de Combo 300 en la Parte 2 del estudio pivotal, se observó EPP en el 3,9% (10/257) de los pacientes, que fue de Grado 3 en el 0,4% (1/257) de los pacientes.
En la población conjunta de encorafenib 300, se notificó EPP en el 51,6% (112/217) de los pacientes. La mayoría de los acontecimientos fueron leves o moderados: de Grado 1 en el 12,4% (27/217) de los pacientes, de Grado 2 en el 26,7% (58/217) de los pacientes y de Grado 3 en el 12,4% (27/217) de los pacientes. El EPP obligó a suspender el tratamiento en el 4,1% (9/217) de los pacientes y a interrumpir o modificar la dosis en el 23,0% (50/217) de los pacientes.
Cáncer colorrectal
En la población tratada con encorafenib 300 mg en combinación con cetuximab, se notificó EPP en el 5,1% (11/216) de los pacientes. La mayoría de las reacciones adversas de EPP fueron de Grado 1 en 3,7% (8/216). Se notificó acontecimientos de Grado 2 en el 0,9% (2/216) de los pacientes, y de Grado 3 en el 0,5% (1/216) de los pacientes. No se requirió interrupción de la dosis, modificación de la dosis o interrupción del tratamiento.
Dermatitis acneiforme
Melanoma
Se notificó dermatitis acneiforme cuando se administró encorafenib en combinación con binimetinib (ver sección 4.8 de la ficha técnica de binimetinib).
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, la dermatitis acneiforme ocurrió en el 33,3% (72/216) de los pacientes y fue principalmente de Grado 1 (en el 25,5% (55/216) de los pacientes) y Grado 2 (en el 6,9% (15/216) de los pacientes). Se notificó reducción o interrupción de la dosis en el 2,3% (5/216) de los pacientes. No se notificó la interrupción del tratamiento. La dermatitis acneiforme fue generalmente reversible.
Fotosensibilidad
Melanoma
En la población global con Combo 450, se observó fotosensibilidad en el 4,0% (11/274) de los pacientes. La mayoría de los acontecimientos fueron de Grado 1-2, se notificaron acontecimientos de Grado 3 en el 0,4% (1/274) de los pacientes y ningún acontecimiento obligó a suspender el tratamiento. Se notificó la interrupción o modificación de la dosis en el 0,4% (1/274) de los pacientes.
En la población conjunta de encorafenib 300, se notificó fotosensibilidad en el 4,1% (9/217) de los pacientes. Todos los acontecimientos fueron de Grado 1 o 2. Ningún acontecimiento requirió suspensión, modificación o interrupción de la dosis.
Paresis facial
Melanoma
En la población global con Combo 450, se produjo paresis facial en el 0,7% (2/274) de los pacientes, incluido el Grado 3 en el 0,4% (1/274) de los pacientes. Los acontecimientos fueron reversibles y ningún acontecimiento dio lugar a la suspensión del tratamiento. Se notificó interrupción o modificación de la dosis en el 0,4% (1/274) de los pacientes.
En la población conjunta de encorafenib 300, se observó paresis facial en el 7,4% (16/217) de los pacientes. La mayoría de los acontecimientos fueron leves o moderados: Grado 1 en 2,3% (5/217), Grado 2 en 3,7% (8/217) y Grado 3 en 1,4% (3/217) de los pacientes. La mediana del tiempo hasta el inicio del primer evento de paresis facial fue de 0,3 meses (rango de 0,1 a 12,1 meses). La paresis facial, en general, fue reversible y obligó a la suspensión del tratamiento en el 0,9% (2/217). Se notificó interrupción o modificación de la dosis en 3,7% (8/217) y se notificó tratamiento sintomático que incluía corticosteroides en 5,1% (11/217) de los pacientes.
Elevación de la CK y rabdomiolisis
Se notificó elevación de la CK y rabdomiolisis cuando se administró encorafenib en combinación con binimetinib en pacientes con melanoma (ver sección 4.8 de la ficha técnica de binimetinib).
Disfunción renal
Melanoma
En la población global con Combo 450, se observó un leve aumento asintomático de la creatinina en sangre, principalmente de Grado 1, en el 6,2% (17/274) de los pacientes que recibieron Combo 450 mg. La incidencia de elevaciones de Grado 3 o 4 fue del 0,7% (2/274). Se notificaron acontecimientos de fallo renal, como lesión renal aguda e insuficiencia renal, en el 3,3% (9/274) de los pacientes tratados con la combinación de encorafenib y binimetinib, con acontecimientos de Grado 3 o 4 en el 2,2% (6/274) de los pacientes. El fallo renal fue por lo general reversible al interrumpir la administración del fármaco, rehidratar al paciente y adoptar otras medidas de soporte.
Cáncer colorrectal
Se notificó elevación de la creatinina en sangre en el 2,8% (6/216) de los pacientes tratados con encorafenib 300 mg en combinación con cetuximab. Todos fueron leves, excepto un acontecimiento de Grado 4. Los acontecimientos de insuficiencia renal fueron de Grado 3 o 4 y se notificaron como lesión renal aguda en el 1,9% (4/216) de los pacientes y fallo renal en el 0,5% (1/216) de los pacientes.
Anomalías de las analíticas hepáticas
Melanoma
Las incidencias de anomalías de las analíticas hepáticas en la población global con Combo 450 se indican a continuación:
En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, la incidencia de anomalías de las analíticas hepáticas fue:
Cáncer colorrectal
La incidencia de aumento de las transaminasas en pacientes tratados con encorafenib 300 mg en combinación con cetuximab fue del 8,8% (19/216) de los pacientes, con Grado 3 o 4 en el 1,4% (3/216) de los pacientes.
Trastornos gastrointestinales
Melanoma
En la población global con Combo 450, se observó diarrea en el 38% (104/274) de los pacientes, que fue de Grado 3 o 4 en el 3,3% (9/274) de los pacientes. La diarrea obligó a suspender el tratamiento en el 0,4% de los pacientes y a interrumpir la administración o modificar la dosis en el 4,4% de los pacientes.
Se produjo estreñimiento en el 24,1% (66/274) de los pacientes, que fue de Grado 1 o 2. Se notificó dolor abdominal en el 27,4% (75/274) de los pacientes, que fue de Grado 3 en el 2,6% (7/274) de los pacientes. Sufrieron náuseas el 41,6% (114/274) de los pacientes, con acontecimientos de Grado 3 o 4 en el 2,6% (7/274) de los pacientes. Sufrieron vómitos el 28,1% (77/274) de los pacientes, con acontecimientos de Grado 3 o 4 en el 2,2% (6/274) de los pacientes.
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se observó diarrea en el 38,4% (83/216) de los pacientes que fue de Grado 3 en el 2,8% (6/216) de los pacientes. La diarrea obligó a suspender el tratamiento en el 0,5% (1/216) de los pacientes y la interrupción o modificación de la dosis en el 3,7% (8/216) de los pacientes.
Se notificó dolor abdominal en el 36,6% (79/216) de los pacientes que fue de grado 3 en el 5,1% (11/216) de los pacientes. Tuvieron náuseas el 38,0% (82/216) de los pacientes con acontecimientos de Grado 3 en el 0,5% (1/216) de los pacientes. Se produjeron vómitos en el 27,3% (59/216) de los pacientes con acontecimientos de Grado 3 en el 1,4% (3/216) de los pacientes. El estreñimiento apareció en el 18,1% (39/216) de los pacientes y fue de Grado 1 o 2.
En general, los trastornos gastrointestinales se controlaron con el tratamiento habitual.
Anemia
Melanoma
En la población global con Combo 450, se notificó anemia en el 19,7% (54/274) de los pacientes, con Grado 3 o 4 en el 4,7% (13/274) de los pacientes. Ningún paciente tuvo que suspender el tratamiento debido a la anemia, aunque en el 1,5% (4/274) fue necesario interrumpir la administración o modificar la dosis.
En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó anemia en el 9,7% (25/257) de los pacientes, que fue de Grado 3-4 en el 2,7% (7/257) de los pacientes.
Dolor de cabeza
Melanoma
En la población global con Combo 450, se produjo dolor de cabeza en el 21,5% (59/274) de los pacientes, que fue de Grado 3 en el 1,5% (4/274) de los pacientes.
En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se notificó dolor de cabeza en un 12,1% (31/257) de los pacientes, que fue de Grado 3 en el 0,4% (1/257) de los pacientes.
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se produjo dolor de cabeza en un 20,4% (44/216) de los pacientes y fue de Grado 1 o 2.
Fatiga
Melanoma
En la población global con Combo 450, se produjo fatiga en el 43,8% (120/274) de los pacientes, que fue de Grado 3 en el 2,9% (8/274) de los pacientes.
En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó fatiga en un 33,5% (86/257) de los pacientes, con acontecimientos de Grado 3-4 en el 1,6% (4/257) de los pacientes.
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab, se notificó fatiga en un 56,9% (123/216) de los pacientes, con acontecimientos de Grado 3 en el 7,9% (17/216) de los pacientes.
Poblaciones especiales
Pacientes de edad avanzada
Melanoma
En la población global con Combo 450 (n = 274), 194 pacientes (70,8%) eran menores de 65 años, 65 pacientes (23,7%) tenían entre 65 y 74 años y 15 pacientes (5,5%) tenían más de 75 años. No se observaron diferencias globales en cuanto a seguridad y eficacia entre los pacientes de edad avanzada (≥65 años) y los más jóvenes.
Los pacientes de ≥ 65 años no experimentaron reacciones adversas más frecuentes que los pacientes más jóvenes.
Cáncer colorrectal
En pacientes tratados con encorafenib 300 mg en combinación con cetuximab (n = 216), 134 pacientes (62%) tenían <65 años, 62 pacientes (28,7%) tenían 65-74 años y 20 pacientes (9,3%) tenían ≥ 75 años. Las reacciones adversas más comunes notificadas con una mayor incidencia en pacientes de ≥ 65 años en comparación con pacientes de < 65 años incluyeron vómitos, dolor en las extremidades y mareos.
Tanto en las poblaciones de melanoma como de cáncer colorrectal, debido a un número muy pequeño de pacientes tratados en el subgrupo de edad de pacientes con edad ≥ 75 años, no se pudieron evaluar las diferencias en la incidencia de reacciones adversas en comparación con pacientes con edad <75 años.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Síntomas
Con dosis de encorafenib comprendidas entre 600 y 800 mg una vez al día, se observó disfunción renal (hipercreatinemia de Grado 3) en 3 de 14 pacientes. La administración más alta de encorafenib se debió a un error posológico en un paciente, que tomó 600 mg dos veces al día durante 1 día (dosis total de 1200 mg). Las reacciones adversas comunicadas por este paciente fueron acontecimientos de Grado 1 de náuseas, vómitos y visión borrosa, que se resolvieron a posteriori.
Tratamiento
No existe un tratamiento específico para la sobredosis de encorafenib.
Puesto que encorafenib se une moderadamente a las proteínas plasmáticas, es probable que la hemodiálisis no sea eficaz para el tratamiento de la sobredosis. No hay un antídoto conocido para encorafenib. En caso de sobredosis, se debe interrumpir la administración de encorafenib y vigilar la función renal y las posibles reacciones adversas. Si es necesario, se administrará tratamiento sintomático y de soporte.
-
5. Propiedades farmacológicas
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes antineoplásicos, inhibidores de la proteínquinasa, código ATC: L01EC03
Mecanismo de acción
Encorafenib es una pequeña molécula competitiva del ATP, inhibidora potente y altamente selectiva de la RAF-quinasa. La concentración inhibidora máxima media (IC50) de encorafenib frente a las enzimas BRAF V600E, BRAF y CRAF se ha calculado en 0,35, 0,47 y 0,30 nM, respectivamente. La semivida de disociación de encorafenib fue >30 horas y dio lugar a una prolongada inhibición de la pERK. Encorafenib suprime la vía RAF/MEK/ERK en células tumorales que expresan diversas formas mutadas de BRAF cinasa (V600E, D y K). De forma específica, encorafenib inhibe in vitro e in vivo el crecimiento de las células del melanoma con mutación BRAF V600E, D y K y el crecimiento de las células del cáncer colorrectal con mutación BRAF V600E. Encorafenib no inhibe las vías RAF/MEK/ERK en células con BRAF no mutado.
Combinación con binimetinib
Encorafenib y binimetinib (un inhibidor de MEK, ver sección 5.1 de la ficha técnica de binimetinib) inhiben la vía MAPK, dando como resultado una mayor actividad antitumoral.
Además, la combinación de encorafenib y binimetinib impide la aparición de resistencia en xenoingertos de melanoma humano con mutación BRAF V600E in vivo.
Combinación con cetuximab
Se ha identificado la reactivación de EGFR como uno de los principales mecanismos de resistencia del CCR BRAF mutado a los inhibidores de BRAF a través de la transducción de señales vía BRAF. Las combinaciones de un inhibidor de BRAF, por ejemplo encorafenib, y agentes dirigidos a EGFR, por ejemplo el cetuximab, han demostrado mejorar la eficacia antitumoral en modelos no clínicos.
Eficacia clínica y seguridad
Melanoma no resecable o metastásico con mutación BRAF V600
La eficacia y seguridad de encorafenib en combinación con binimetinib se evaluaron en un estudio de fase III de 2 partes, aleatorizado (1:1:1), con control activo, abierto y multicéntrico, en pacientes con melanoma no resecable o metastásico y con mutación BRAF V600E o K detectada mediante una prueba específica para el gen BRAF (estudio CMEK162B2301). Los pacientes presentaban melanoma primario cutáneo o desconocido, confirmado histológicamente, pero se excluyeron aquellos con melanoma uveal o de mucosas. Se permitió a los pacientes recibir tratamiento adyuvante previo y una primera línea de inmunoterapia para la enfermedad no resecable localmente avanzada o metastásica. No se permitió el tratamiento previo con inhibidores de BRAF/MEK.
Estudio CMEK162B2301, parte 1
En la parte 1, los pacientes del estudio se aleatorizaron a recibir encorafenib 450 mg una vez al día por vía oral y binimetinib 45 mg dos veces al día por vía oral (Combo 450, n = 192), encorafenib 300 mg una vez al día por vía oral (Enco 300, n = 194) o vemurafenib 960 mg dos veces al día por vía oral (en adelante, Vem, n = 191). El tratamiento continuó hasta la progresión de la enfermedad o la aparición de toxicidad inaceptable. La aleatorización fue estratificada según el estadio del American Joint Committee on Cancer (AJCC) (IIIB, IIIC, IVM1a o IVM1b, respecto a IVM1c), el estado funcional del Eastern Cooperative Oncology Group (ECOG) (0 respecto a 1) y la inmunoterapia previa para la enfermedad no resecable o metastásica («sí» respecto a «no»).
La variable primaria de eficacia fue la supervivencia libre de progresión (SLP) para Combo 450 comparado con vemurafenib, evaluada por un comité de revisión central independiente que desconocía la asignación al tratamiento. La SLP evaluada por los investigadores fue un análisis auxiliar. Otra variable secundaria fue la SLP para Combo 450 comparada con Enco 300. Otras comparaciones secundarias de la eficacia entre Combo 450 y vemurafenib o Enco 300 fueron la supervivencia global (SG), la tasa de respuesta global (TRG), la duración de la respuesta (DR) y la tasa de control de la enfermedad (TCE), evaluadas por el comité de revisión central independiente y por los investigadores.
La mediana de edad de los pacientes fue de 56 años (intervalo, 20-89); el 58% eran varones, el 90% eran caucásicos y el 72% presentaban un estado funcional ECOG inicial de 0. La mayoría de los pacientes presentaban enfermedad metastásica (95%) en estadio IVM1c (64%); el 27% de los pacientes presentaban valores iniciales elevados de lactato deshidrogenasa (LDH) en suero, y el 45% tenían afectación tumoral en al menos 3 órganos en el momento inicial (un 3,5% tenían metástasis cerebrales). 27 pacientes (5%) habían recibido inhibidores del punto de control inmunitario (anti-PD1/PDL1 o ipilimumab) (8 pacientes del grupo de Combo 450 (4%); 7 pacientes del grupo de vemurafenib (4%); 12 pacientes del grupo de Enco 300 (6%)) incluyendo 22 pacientes como tratamiento para la enfermedad metastásica (6 pacientes del grupo Combo 450; 5 pacientes del grupo vemurafenib; 11 pacientes del grupo Enco 300) y 5 pacientes como tratamiento adyuvante (2 pacientes del grupo Combo 450; 2 pacientes del grupo vemurafenib; 1 paciente del grupo Enco 300).
La mediana de la duración de la exposición fue de 11,7 meses en los pacientes tratados con Combo 450, 7,1 meses en los pacientes tratados con Enco 300 y 6,2 meses en los pacientes tratados con vemurafenib. La mediana de la intensidad relativa de la dosis (IRD) para Combo 450 fue del 100% para encorafenib y del 99,6% para binimetinib; la mediana de la IRD fue del 86,2% para Enco 300 y del 94,5% para vemurafenib.
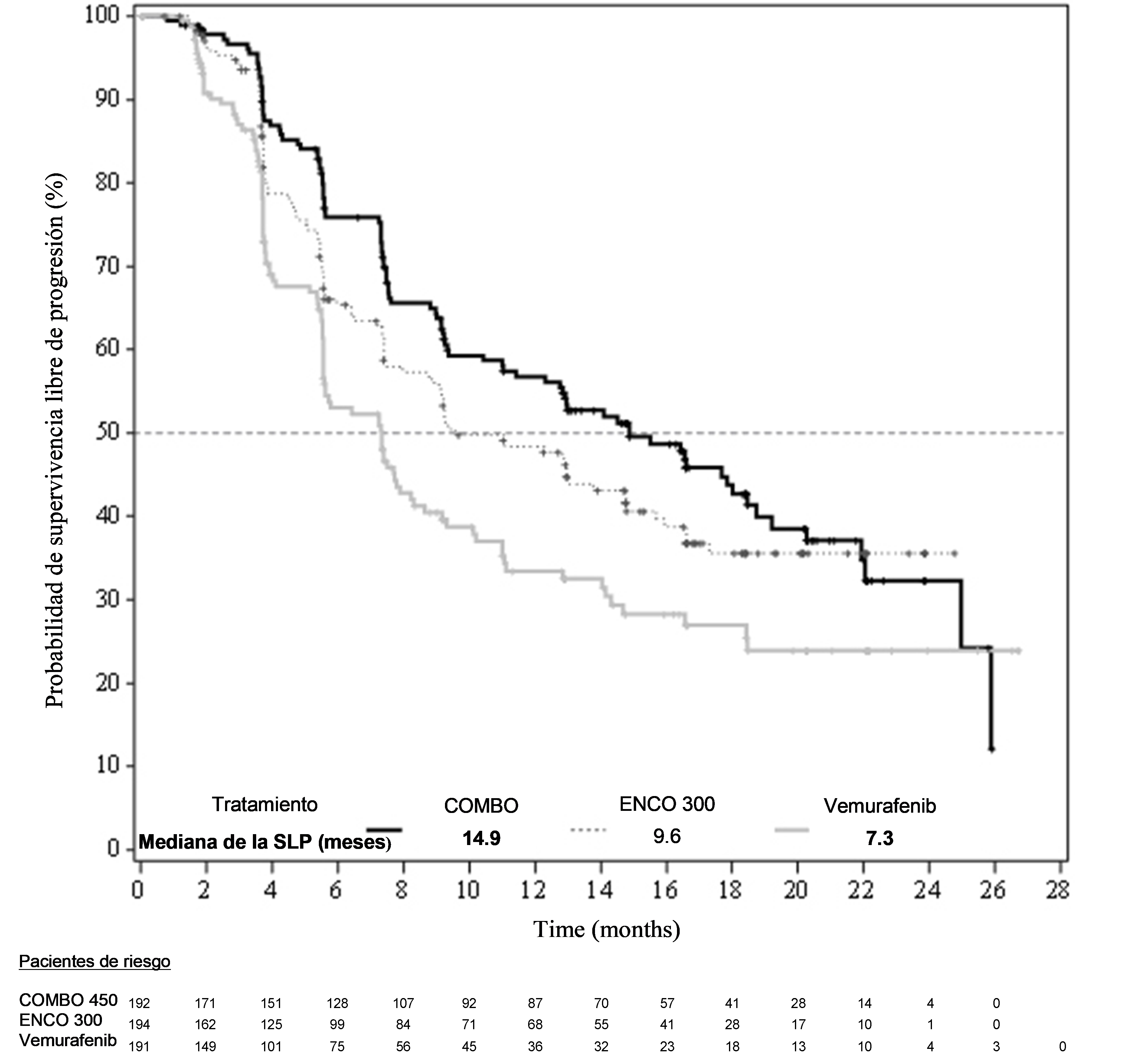
Parte 1 del estudio CMEK162B2301 demostró una mejora estadísticamente significativa en la SLP para los pacientes tratados con Combo 450, comparado con los pacientes tratados con vemurafenib. En la tabla 6 y la figura 1 se resumen la SLP y otros resultados de eficacia según el análisis central de los datos realizado por un comité de radiología central independiente que desconocía la asignación al tratamiento.
Los resultados de eficacia basados en la evaluación de los investigadores coincidieron con los del análisis central independiente. El análisis no estratificado de subgrupos demostró la estimación puntual a favor de Combo 450, incluido el valor de LDH basal, el estado funcional ECOG y el estadio AJCC.
Tabla 6: Estudio CMEK162B2301, Parte 1: Resultados de supervivencia libre de progresión y respuesta global confirmada (análisis central independiente)
Encorafenib + binimetinib N=192
(Combo 450)
Encorafenib N=194
(Enco 300)
Vemurafenib N=191
(Vem)Fecha de corte: 19 de mayo de 2016 SLP (análisis principal) Número de acontecimientos (progresión de la enfermedad (PE)) (%) 98 (51,0) 96 (49,5) 106 (55,5) Mediana, meses (IC 95%)
14,9 (11,0 – 18,5)
9,6 (7,5 – 14,8)
7,3 (5,6 – 8,2)
HRa (IC 95%) (vs Vem) Valor de p (orden logarítmico estratificado)b
0,54 (0,41 – 0,71) <0.001
HRa (IC 95%) (vs Vem) Valor de p nominal
0,68 (0,52 – 0,90) 0,007
HRa (IC 95%) (vs Enco 300) Valor de p (orden logarítmico estratificado)b
0,75 (0,56 – 1,00) 0,051
Respuestas globales confirmadas Tasa de respuesta global, n (%) 121 (63,0) 98 (50,5) 77 (40,3) (IC 95%) (55,8 – 69,9) (43,3 – 57,8) (33,3 – 47,6) RC, n (%) 15 (7,8) 10 (5,2) 11 (5,8) RP, n (%) 106 (55,2) 88 (45,4) 66 (34,6) EE, n (%) 46 (24,0) 53 (27,3) 73 (38,2) TCE, n (%) 177 (92,2) 163 (84,0) 156 (81,7) (IC 95%) (87,4 – 95,6) (78,1 – 88,9) (75,4 – 86,9) Duración de la respuesta Mediana, meses (IC 95%)
16,6 (12,2 – 20,4)
14,9 (11,1- NE)
12,3 (6,9 – 16,9)
Análisis actualizado, fecha de corte: 07 de noviembre de 2017 SLP Número de acontecimientos (enfermedad progresiva) (%) 113 (58,9) 112 (57,7) 118 (61,8) Mediana, meses (IC 95%)
14,9 (11,0 – 20,2)
9,6 (7,4 -14,8)
7,3 (5,6 – 7,9)
HRa (IC 95%) (vs Vem) Valor de p nominal
0,51 (0,39 – 0,67) <0,001
HRa (IC 95%) (vs Vem) Valor de p nominal
0,68 (0,52 – 0,88) 0,0038
HRa (IC 95%) (vs Enco 300) Valor de p nominal
0,77 (0,59 – 1,00) 0,0498
IC=intervalo de confianza; RC=respuesta completa; TCE=tasa de control de la enfermedad (RC + RP + EE + no-RC/no-PE; no-RC/no-PE se aplica solo a los pacientes sin una lesión diana que no alcanzan RC o sufren PE); HR=Hazard ratio; NE=no estimable; SLP=supervivencia libre de progresión; RP=respuesta parcial; EE=enfermedad estable. Vem=vemurafenib.
a El Hazard ratio se basa en un modelo de riesgos proporcionales de Cox estratificado.
b Valor de p de orden logarítmico (bilateral).
Figura 1 Estudio CMEK162B2301, Parte 1: Gráfico de Kaplan-Meier de la supervivencia libre de progresión según el análisis central independiente (fecha de corte: 19 de mayo de 2016)
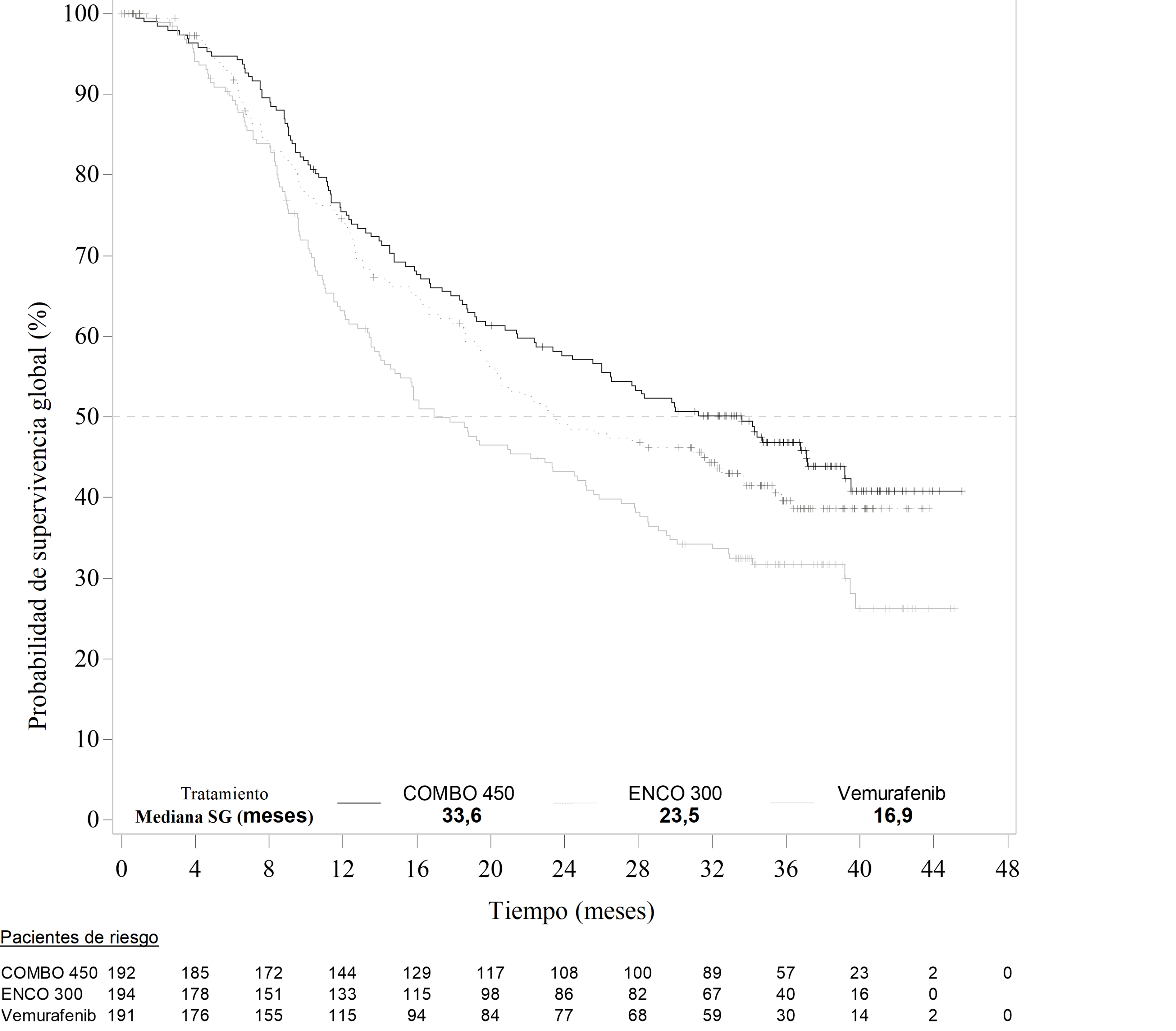
Un análisis interino de la SG de la parte 1 del estudio CMEK162B2301, (fecha de corte 07 de noviembre de 2017), demostró una mejora estadísticamente significativa de la SG del Combo 450 comparado con vemurafenib (ver Tabla 7 y Figura 2).Una proporción similar de pacientes en cada grupo de tratamiento recibieron a posteriori inhibidores del punto de control inmunitario, principalmente pembrolizumab, nivolumab e ipilimumab (34,4% en el grupo del Combo 450, 36,1% en el grupo de encorafenib y 39,8% en el grupo de vemurafenib).
Tabla 7: Estudio CMEK162B2301, Parte 1: Resultados provisionales de supervivencia global (fecha de corte: 7 Noviembre 2017)
Encorafenib + binimetinib N=192 (Combo 450)
Encorafenib N=194
(Enco 300)
Vemurafenib N=191
(Vem)SG Número de acontecimientos (%) 105 (54,7) 106 (54,6) 127 (66,5) Mediana, meses (IC 95%)
33,6 (24,4 – 39,2)
23,5 (19,6 – 33,6)
16,9 (14,0 – 24,5)
Supervivencia a los 12 meses (IC 95%)
75,5% (68,8 – 81,0)
74,6% (67,6 – 80,3)
63,1% (55,7 – 69,6)
Supervivencia a los 24 meses (IC 95%)
57,6% (50,3 – 64,3)
49,1% (41,5 – 56,2)
43,2% (35,9 – 50,2)
HR (IC 95%) (vs Vem) Valor de p (orden logarítmico estratificado)
0,61 (0,47 – 0,79) <0,0001
HR (IC 95%) (vs Enco 300) Valor de p (orden logarítmico estratificado)
0,81 (0,61 – 1,06) 0,061
Figura 2 Estudio CMEK162B2301, Parte 1: Gráfica Kaplan-Meier de la supervivencia global provisional (fecha de corte: 7 noviembre 2017)
Calidad de vida (CdV) (fecha de corte: 19 de mayo de 2016)
Para explorar los resultados percibidos por el paciente (RPP) respecto a la calidad de vida relacionada con la salud, el estado funcional, los síntomas del melanoma y las reacciones adversas relacionadas con el tratamiento, se utilizaron la Evaluación Funcional para el Tratamiento del Cáncer – Melanoma (FACT-M), el cuestionario de calidad de vida de la European Organization for Research and Treatment of Cancer (EORTC QLQ-C30) y el cuestionario de cinco dimensiones y tres niveles del Grupo EuroQoL (EQ-5D-5L). Hubo un retraso significativo hasta el deterioro definitivo del 10% en el FACT-M y el EORTC QLQ-C30 en los pacientes que recibieron Combo 450, respecto a los otros tratamientos. La mediana del tiempo hasta el deterioro definitivo del 10% en la puntuación del FACT-M no se alcanzó en el grupo de Combo 450 y fue de 22,1 meses (IC 95%: 15,2 – NE) en el grupo de vemurafenib, con una HR para la diferencia de 0,46 (IC95 %: 0,29 – 0,72). Un análisis del tiempo hasta el deterioro definitivo del 10% en la puntuación EORTC QLQ-C30 aportó resultados similares.
En los pacientes que recibieron Combo 450 no hubo cambios o bien hubo una leve mejora en el cambio medio respecto a la puntuación inicial del índice EQ-5D-5L en todas las visitas, mientras que en los pacientes tratados con vemurafenib o encorafenib se observaron disminuciones en todas las visitas (con diferencias estadísticamente significativas). Una evaluación del cambio de puntuación a lo largo del tiempo indicó la misma tendencia para EORTC QLQ-C30 y en todas las visitas para FACT‑M.
Parte 2 del estudio CMEK162B2301:
La parte 2 del estudio CMEK162B2301 fue diseñada para evaluar la contribución de binimetinib a la combinación de encorafenib y binimetinib.
La SLP de encorafenib 300 mg por vía oral diarios en combinación con binimetinib 45 mg por vía oral dos veces al día (Combo 300, n = 258) se comparó con la SLP de Enco 300 (n = 280, incluyendo 194 pacientes de la parte 1 y 86 pacientes de la parte 2). El reclutamiento de la parte 2 se inició tras la aleatorización de todos los pacientes de la parte 1.
Los datos preliminares de la parte 2 a la fecha de corte del 9 de noviembre de 2016, demostraron la contribución de binimetinib con una mejora de la mediana de SLP estimada de 12,9 meses (IC 95%: 10,1 – 14,0) para el Combo 300 comparado con los 9,2 meses (IC 95%: 7,4 – 11,0) para Enco 300 (Partes 1 y 2) según el análisis central independiente. Se observaron resultados similares en el análisis por el investigador. La TRG confirmada por el análisis central independiente fue del 65,9% (IC 95%: 59,8 – 71,7) para el Combo 300 y del 50,4% (IC 95%: 44,3 – 56,4) para Enco 300 (Partes 1 y 2). La mediana de DR de las respuestas confirmadas por el análisis central independiente fue de 12,7 meses [IC 95%: 9,3 – 15,1] para el Combo 300 y 12,9 meses [IC 95%: 8,9 – 15,5] para Enco 300. La mediana de duración del tratamiento fue superior para el Combo 300 vs Enco 300, 52,1 semanas vs 31,5 semanas.
En el análisis de seguridad de los estudios agrupados, la incidencia de nuevas prolongaciones del intervalo QTc >500 ms fue del 0,7% (2/268) en el grupo de encorafenib 450 mg más binimetinib, y del 2,5% (5/203) en el grupo de encorafenib en monoterapia. Se observaron prolongaciones del intervalo QTc >60 ms, comparado con los valores previos al tratamiento, en el 4,9% (13/268) de los pacientes del grupo de encorafenib más binimetinib, y del 3,4% (7/204) en el grupo de encorafenib en monoterapia (ver las secciones 4.2 y 4.4).
Cáncer colorrectal metastásico con mutación BRAF V600E – Estudio ARRAY-818-302
Encorafenib en combinación con cetuximab se evaluó en un ensayo aleatorizado, controlado de forma activa, abierto, multicéntrico (ARRAY 818-302 BEACON CRC). Los pacientes elegibles debían tener cáncer colorrectal metastásico con mutación BRAF V600E que había progresado después de 1 o 2 terapias sistémicas previas. Los pacientes reclutados eran tributarios de recibir cetuximab por aprobación a nivel local en relación al estado RAS tumoral. Se prohibió el uso previo de inhibidores RAF, inhibidores MEK o inhibidores EGFR. La aleatorización fue estratificada según el estado funcional del Eastern Cooperative Oncology Group (ECOG), el uso previo de irinotecan y la fuente de cetuximab.
Un total de 665 pacientes se aleatorizaron (1: 1: 1) para recibir encorafenib 300 mg por vía oral una vez al día en combinación con cetuximab dosificado según su ficha técnica aprobada (n = 220), o encorafenib 300 mg por vía oral una vez al día en combinación con binimetinib 45 mg por vía oral dos veces al día y cetuximab dosificado según su ficha técnica aprobada (n = 224) o Control (irinotecan con cetuximab o irinotecan / 5-fluorouracil / ácido folínico (FOLFIRI) con cetuximab, n = 221). El tratamiento continuó hasta la progresión de la enfermedad o toxicidad inaceptable.
Las variables principales de eficacia fueron la supervivencia global (SG) y la tasa de respuesta global (TRG) evaluada por un comité de revisión central independiente que desconocía la asignación al tratamiento, comparando encorafenib 300 mg en combinación con cetuximab versus control. Otras medidas de eficacia se resumen en la Tabla 8 a continuación.
La mediana de edad de los pacientes fue de 61 años (intervalo 26-91), 47% eran varones y 83% eran blancos. El 51% de los pacientes presentaban un estado funcional ECOG inicial de 0, y el 51% recibió previamente irinotecán. El 46,8% de los pacientes tenían afectación tumoral en al menos 3 órganos en el momento inicial del estudio.
La mediana de la duración de la exposición fue de 3,2 meses en pacientes tratados con encorafenib 300 mg en combinación con cetuximab, y 1,4 meses en pacientes tratados con irinotecan /cetuximab o FOLFIRI / cetuximab (grupo de control). En pacientes tratados con la combinación de encorafenib 300 mg y cetuximab, la mediana de la intensidad relativa de la dosis (IRD) fue del 98% para encorafenib y del 93,5% para cetuximab. En el grupo de control, la mediana de la IRD fue del 85,4% para cetuximab, del 75,7% para irinotecán y en el subgrupo de pacientes que recibieron ácido folínico y 5-FU, la mediana de la IRD fue del 75,2% y 75% respectivamente.
Encorafenib 300 mg en combinación con cetuximab demostró una mejora estadísticamente significativa en SG, TRG y SLP en comparación con el grupo de control. Los resultados de eficacia se resumen en la Tabla 8 y las Figuras 3 y 4.
Los resultados de eficacia basados en la evaluación de los investigadores coincidieron con los del análisis central independiente.
Tabla 8: Estudio ARRAY-818-302: Resultados de eficacia
Encorafenib con cetuximab Irinotecan con cetuximab o FOLFIRI con cetuximab (Control) Fecha de corte: 11 de febrero 2019 (Análisis primario) SG Número de pacientesa 220 221 Número de acontecimientos (%) 93 (42,3) 114 (51,6) Mediana, meses (IC 95%)
8,4 (7,5-11,0) 5,4 (4,8- 6,6) HR (IC 95%)b,c (vs Control) valor de p b,c
0,60 (0,41-0,88) 0,0002
Mediana de la duración del seguimiento, meses (IC 95%)
7,6 (6,4 – 9,20)
7,2 (6,1 – 8,1)
TRG (por comité de revisión central independiente) Número de pacientese 113 107 TRG n (%) (IC 95% )f
23 (20,4) (13,4 – 29,0)
2 (1,9) (0,2 – 6,6)
Valor de p b,d,g <0,0001 RC, n (%) 6 (5,3) 0 RP, n (%) 17 (15,0) 2 (1,9) EE, n (%) 57 (50,4) 26 (24,3) TCE, n (%) (IC 95%)f
84 (74,3) (65,3 – 82,1)
33 (30,8) (22,3 – 40,5)
SLP (por comité de revisión central independiente) Número de pacientesa 220 221 Número de acontecimientos (%) 133 (60,5) 128 (57,9) Mediana SLP, meses (IC 95%) 4,2 (3,7 – 5,4) 1,5 (1,5 – 1,7) HR ( IC 95%)b,c Valor de p b,d
0,40 (0,30 – 0,55) < 0,0001
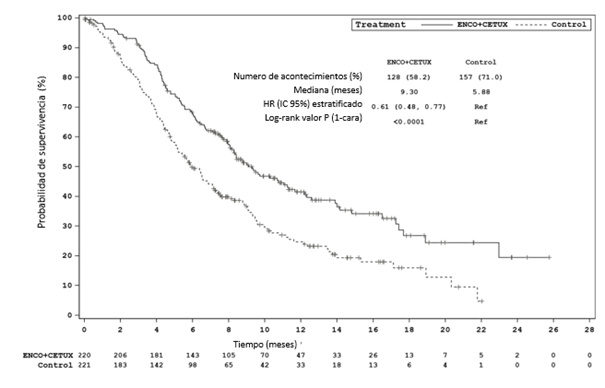
Análisis actualizado, fecha de corte: 15 de agosto de 2019 SG Número de pacientesa 220 221 Número de acontecimientos (%) 128 (58,2) 157 (71,0) Mediana, meses (IC 95%) 9,3 (8,0 – 11,3) 5,9 (5,1 – 7,1) HR (IC 95%)b (vs Control) Valor de p b,d,h
0,61 (0,48 – 0,77) < 0,0001
Mediana de la duración del seguimiento, meses (IC 95%)
12,3 (11,1 – 14,1)
12,9 (10,9 – 14,6)
TRG (por comité de revisión central independiente) Número de pacientesa 220 221 TRG n (%) (IC 95%)f
43 (19,5) (14,5 – 25,4)
4 (1,8) (0,5 – 4,6)
Valor de p b,d,g,h <0,0001 RC, n (%) 7 (3,2) 0 RP, n (%) 36 (16,4) 4 (1,8) EE, n (%) 117 (53,2) 59 (26,7) TCE, n (%) (IC 95%)f
167 (75,9) (69,7 – 81,4)
69 (31,2) (25,2 – 37,8)
SLP (por comité de revisión central independiente) Número de pacientesa 220 221 Número de acontecimientos (%) 167 (75,9) 147 (66,5) Mediana SLP, meses (IC 95%) 4,3 (4,1 – 5,5)
1,5 (1,5 – 1,9)
HR (IC 95%)b Valor de p b,d,h
0,44 (0,35 – 0, 55) < 0,0001
IC=intervalo de confianza; RC=respuesta completa; HR=Hazard ratio;TRG= tasa de respuesta global; SG= supervivencia global; RP=respuesta parcial; EE=enfermedad estable; TCE=tasa de control de la enfermedad (RC + RP + EE + no-RC/no-PE; no-RC/no-PE se aplica solo a pacientes con enfermedades no medibles que no alcanzan RC o sufren PE)
a fase 3 aleatorizado, conjunto de análisis completo
b Estratificado por ECOG PS, fuente de cetuximab y uso previo de irinotecán en la aleatorización
c IC repetido derivado usando los límites de Lan DeMets O’Brien-Fleming asociados con la fracción de información observada en el análisis intermedio
d 1 lado
e Entre los primeros 331 pacientes aleatorizados
f Método de Clopper-Pearson
g Test Cochran Mantel-Haenszel
hValor p nominal
Figura 3: Estudio ARRAY-818-302: Gráfico de Kaplan-Meier de supervivencia global (fecha de corte: 11 de febrero 2019)
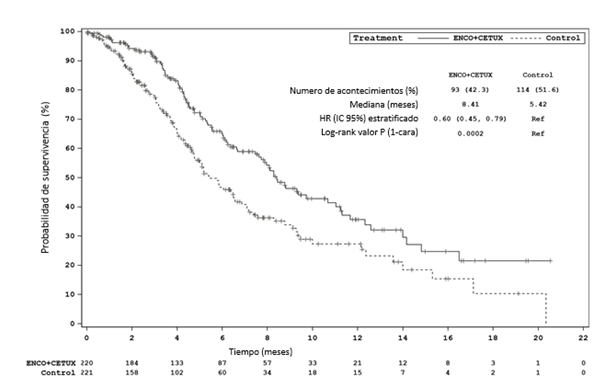
Figura 4: Estudio ARRAY-818-302: Gráfico de Kaplan-Meier de supervivencia global (fecha de corte: 15 de agosto 2019)
Electrofisiología cardíaca
En el análisis de seguridad del Fase 3 (ARRAY-818-302), la incidencia de la nueva prolongación del intervalo QTcF > 500 ms fue del 3,2% (7/216) y la prolongación del intervalo QTcF > 60 ms, comparado con los valores previos al tratamiento, fue del 8,8% (19/216) en el grupo de seguridad del grupo que recibió encorafenib en combinación con cetuximab (ver las secciones 4.2 y 4.4).
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con encorafenib en uno o más grupos de la población pediátrica en el melanoma (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con encorafenib en todos los grupos de la población pediátrica en carcinoma colorrectal (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
La farmacocinética de encorafenib se estudió en voluntarios sanos y en pacientes con tumores sólidos, incluido el melanoma cutáneo avanzado y no resecable o metastásico con mutación BRAF V600E o K, y en pacientes adultos con cáncer colorrectal metastásico con mutación BRAF V600E. La farmacocinética de encorafenib ha demostrado ser aproximadamente lineal tras una o varias dosis. Tras la administración repetida una vez al día, se alcanzó la situación de equilibrio a los 15 días. Es probable una tasa de acumulación de aproximadamente 0,5 debido a la autoinducción de la CYP3A4. La variabilidad interindividual (% de CV) en la AUC oscila entre el 12,3% y el 68,9%.
Absorción
Tras la administración oral, encorafenib se absorbe rápidamente, con una mediana de Tmáx de 1,5 a 2 horas. Después de la administración oral de una sola dosis de 100 mg de [14C] encorafenib a voluntarios sanos, se absorbió el 86% de la misma. La administración de una dosis de 100 mg de encorafenib junto con una comida con alto contenido en grasas y calorías, hizo que la Cmáx disminuyera en un 36%, aunque el AUC no cambió. En un estudio de interacciones farmacológicas con voluntarios sanos se determinó que el grado de exposición a encorafenib no se alteraba en presencia de un inhibidor de la bomba de protones (rabeprazol).
Distribución
Encorafenib se une moderadamente (86,1%) a proteínas plasmáticas humanas in vitro. Después de la administración oral de una sola dosis de 100 mg de [14C] encorafenib a voluntarios sanos, la tasa media (DE) de concentración en sangre/plasma es de 0,58 (0,02) y el volumen aparente de distribución (Vz/F) medio (% de CV) de encorafenib es de 226 litros (32,7%).
Biotransformación
Después de la administración oral de una sola dosis de 100 mg de [14C] encorafenib a voluntarios sanos, se observó que la vía de eliminación principal del fármaco es el metabolismo (el 88% de la dosis radiactiva recuperada, aproximadamente). La principal reacción de biotransformación de encorafenib fue la N‑desalquilación. Otras rutas metabólicas importantes implicadas son la hidroxilación, la hidrólisis del carbamato, la glucuronidación indirecta y la formación de conjugados con glucosa.
Eliminación
Después de la administración oral de 100 mg de [14C] encorafenib a voluntarios sanos, la radiactividad se eliminó de forma equivalente a través de las heces y de la orina (media del 47,2 %). En la orina, el 1,8% de la radiactividad se excretó como encorafenib. El aclaramiento aparente (CL/F) medio (% de CV) de encorafenib fue de 27,9 l/h (9,15%). La mediana (intervalo) de la semivida de eliminación (T1/2) de encorafenib fue de 6,32 h (3,74 a 8,09 h).
Interacciones farmacológicas
No se evidenció interacción farmacológica entre encorafenib y cetuximab.
Efecto de las isoenzimas del CYP sobre encorafenib
Encorafenib se metaboliza por acción de las enzimas CYP3A4, CYP2C19 y CYP2D6. In vitro, la CYP3A4 realizó la principal contribución enzimática a la eliminación oxidativa total de encorafenib en microsomas hepáticos humanos (aprox. 83,3%), seguida de la CYP2C19 y la CYP2D6 (aprox. 16,0% y 0,71%, respectivamente).
El efecto de la coadministración de un inductor potente de CYP3A4 sobre la exposición a encorafenib no se ha estudiado en un ensayo específico. La administración repetida de dosis de 450 mg de encorafenib una vez al día y 45 mg de binimetinib dos veces al día en pacientes con melanoma con modafinilo, un inductor moderado de CYP3A4, disminuyó el AUC en estado estacionario de encorafenib en un 24% y la Cmáx en un 20%, en comparación con encorafenib solo.
Efecto de encorafenib sobre los sustratos del CYP
In vitro, encorafenib se muestra como un inhibidor reversible relativamente potente de la UGT1A1, CYP2B6, CYP2C9 y CYP3A4/5, así como un inhibidor dependiente del tiempo de CYP3A4. Encorafenib indujo la CYP1A2, CYP2B6, CYP2C9 y CYP3A4 en hepatocitos primarios humanos.
La administración repetida de dosis de encorafenib 450 mg una vez al día y binimetinib 45 mg dos veces al día en pacientes con melanoma con una dosis única de cóctel de sustrato sonda CYP redujo el AUC de midazolam 2 mg (sustrato de CYP3A4) en un 82 % y la Cmáx en un 74 %. Disminuyó el AUC de omeprazol 20 mg (sustrato de CYP2C19) en un 17 % y no cambió la Cmax y aumentó el AUC de cafeína 50 mg (sustrato de CYP1A2) en un 27 % y la Cmax en un 13 %. Disminuyó la proporción del metabolito de losartán E3174 a las concentraciones de losartán (sustrato de CYP2C9) en la orina en un 28 % y no cambió la proporción de las concentraciones del metabolito de dextrometorfano (dextrorfano) a las de dextrometorfano (sustrato de CYP2D6) en la orina. Estos resultados indican una inducción potente de CYP3A4, una inhibición leve de CYP1A2 y ningún impacto en la farmacocinética de los sustratos de CYP2C19. A partir de los datos urinarios, no se puede concluir definitivamente sobre la potencia inhibidora de CYP2C9 y CYP2D6. No hay datos disponibles para los metabolizadores lentos de CYP2D6.
Una dosis única de encorafenib 450 mg y binimetinib 45 mg redujo el AUC y la Cmáx de bupropion 75 mg (sustrato CYP2B6) en £ 25%. La administración repetida de encorafenib 450 mg al día y binimetinib 45 mg dos veces al día redujo el AUC y la Cmax de bupropion en £ 26%, y aumentó el AUC del metabolito activo hidroxibupropión en un 49%, lo que indica inducción leve.
Para la administración concomitante con sustratos de la UGT1A1 sometidos a extracción intestinal, se puede esperar una interacción mínima a moderada. Aunque binimetinib es un sustrato de la UGT1A1, no está sometido a extracción intestinal y, por consiguiente, no se prevén interacciones farmacológicas con encorafenib. Además, no se han observado diferencias clínicas en cuanto a la exposición cuando binimetinib se administra conjuntamente con encorafenib.
Efecto de los transportadores sobre encorafenib
Se ha constatado que encorafenib es un sustrato de los transportadores de la glucoproteína P (gp-P). Es improbable que la inhibición de la gp-P provoque un aumento clínicamente importante de las concentraciones de encorafenib, ya que encorafenib tiene una elevada permeabilidad intrínseca. Se investigó in vitro la implicación de varias familias de transportadores de captación (OCT1, OATP1B1, OATP1B3 y OATPB1) utilizando inhibidores apropiados de los transportadores. Los datos indican que los transportadores de captación hepática no están implicados en la distribución de encorafenib en los hepatocitos humanos primarios.
Efecto de encorafenib sobre los transportadores
La administración repetida de 450 mg de encorafenib una vez al día y 45 mg de binimetinib dos veces al día con una dosis única de rosuvastatina (un sustrato de OATP1B1, OATP1B3 y BCRP) aumentó la Cmáx de rosuvastatina en 2,7 veces y el AUC en 1,6 veces, lo que indica una inhibición leve de OATP1B1, OATP1B3 y/o transportadores BCRP
In vitro, encorafenib inhibió el transportador hepático OCT1, pero no es probable que sea un inhibidor clínicamente efectivo. Conforme a los estudios in vitro, encorafenib tendría la capacidad de inhibir los transportadores renales OCT2, OAT1 y OAT3 a concentraciones clínicas. Además, encorafenib podría inhibir la P-gp en el intestino a las concentraciones clínicas previstas.
Poblaciones especiales
Edad
Según un análisis farmacocinético poblacional, la edad del paciente sería una covariable significativa para el volumen de distribución de encorafenib, aunque con una alta variabilidad. Dada la pequeña magnitud de estos cambios y su elevada variabilidad, no es probable que sean clínicamente significativos, por lo que en pacientes de edad avanzada no son necesarios ajustes de dosis.
Sexo
Según un análisis farmacocinético poblacional, el sexo del paciente no sería una covariable significativa para la eliminación o el volumen de distribución. Por lo tanto, no se prevén cambios importantes en la exposición a encorafenib en función del sexo.
Peso corporal
Según un análisis farmacocinético poblacional, el peso corporal del paciente sería una covariable significativa para la eliminación o el volumen de distribución. Sin embargo, dada la pequeña magnitud del cambio en la eliminación y la elevada variabilidad en el volumen de distribución previstas en el modelo no es probable que el peso ejerza una influencia clínicamente relevante sobre la exposición a encorafenib.
Etnia
No existen diferencias clínicamente relevantes en la farmacocinética de encorafenib entre asiáticos y no asiáticos. No se dispone de datos suficientes para evaluar las posibles diferencias en la exposición a encorafenib entre otras etnias.
Insuficiencia hepática
Los resultados de un estudio clínico específico indican que existe un 25 % más de exposición total a encorafenib en pacientes con insuficiencia hepática leve (Child-Pugh clase A) comparado con los que tienen una función hepática normal. Esto se traduce en un aumento del 55 % en la exposición a encorafenib libre.
La farmacocinética de encorafenib no se ha evaluado en pacientes con insuficiencia hepática moderada (Child-Pugh clase B) o grave (Child-Pugh clase C). Puesto que encorafenib se metaboliza y elimina principalmente por vía hepática, según el modelo PBPK los pacientes con insuficiencia hepática moderada o grave pueden presentar un mayor grado de exposición que aquellos que tienen una insuficiencia hepática leve. No se puede hacer una recomendación posológica en pacientes con insuficiencia hepática moderada o grave (ver las secciones 4.2 y 4.4).
Insuficiencia renal
La eliminación renal de encorafenib es mínima. No se han realizado estudios específicos para evaluar los efectos de la insuficiencia renal sobre la farmacocinética de encorafenib.
En un análisis farmacocinético poblacional, no se observó una tendencia clara en el CL/F de encorafenib en pacientes con insuficiencia renal leve (velocidad de filtración glomerular estimada (VFGe) 60 a 90 ml/min/1,73 m2) o moderada (VFGe 30 a 59 ml/min/1,73 m2) en comparación con aquellos cuya función renal era normal (VFGe ≥90 ml/min/1,73 m2). En los pacientes con insuficiencia renal leve o moderada se ha previsto una pequeña disminución del CL/F (≤5 %), probablemente sin relevancia clínica. No se ha estudiado la farmacocinética de encorafenib en pacientes con insuficiencia renal grave.
5.3 Datos preclínicos sobre seguridad
En los estudios de toxicidad en ratas de 4 y 13 semanas de duración, se observaron signos clínicos de disminución del peso corporal y reducción del peso de los epidídimos y la próstata, y hallazgos microscópicos en testículos, epidídimos, estómago y piel. Estas manifestaciones revirtieron parcialmente tras un periodo de recuperación de 4 semanas. Además, en el estudio de toxicidad en ratas de 13 semanas de duración, se observaron cambios clínicos patológicos reversibles en dosis ≥100 mg/kg/d. No se pudo establecer el NOAEL para el estudio de 4 semanas. El NOAEL determinado en el estudio de 13 semanas fue de más de 10 veces la exposición terapéutica humana.
En los estudios de toxicidad en monos de 4 semanas y 13 semanas de duración, se observaron acontecimientos aislados/esporádicos de emesis y diarrea, así como lesiones oftálmicas, ligeramente por encima de las exposiciones terapéuticas en humanos. Las lesiones oftálmicas fueron parcialmente reversibles y consistían en una separación o desprendimiento de la retina entre la capa exterior de conos, bastones y el epitelio pigmentario retiniano, en la fóvea central de la mácula. Esta observación fue similar a la descrita en humanos como coriorretinopatía serosa central o retinopatía serosa central.
Encorafenib no tuvo efectos genotóxicos.
No se han realizado estudios de fertilidad con encorafenib. En los estudios de toxicidad de 13 semanas en ratas, la administración de encorafenib a dosis de 6 mg/kg/d (más de 5 veces la exposición humana a la dosis terapéutica) provocó una reducción del peso de los testículos y epidídimos, con degeneración tubular y oligospermia. En el estudio de 13 semanas, se observó una reversibilidad parcial a las dosis más altas (60 mg/kg/d).
El estudio de desarrollo embriofetal en ratas puso de manifiesto que encorafenib induce toxicidad fetal, con disminución del peso del feto y retraso en el desarrollo óseo.
El estudio de desarrollo embriofetal en conejos puso de manifiesto que encorafenib induce toxicidad fetal, con disminución del peso del feto y cambios transitorios en el desarrollo óseo. En algunos fetos se observó dilatación del arco aórtico.
Encorafenib tuvo efectos fototóxicos en un ensayo in vitro de captación del rojo neutro (3T3 NRU). Encorafenib no tuvo efectos sensibilizantes en un ensayo in vivo de sensibilización en ratones. En conjunto, estos datos indican que encorafenib presenta un riesgo potencial fototóxico y un riesgo mínimo de sensibilización a dosis terapéuticas en los pacientes.
-
6. Datos Farmacéuticos
6.1 Lista de excipientes
Contenido de la cápsula
Copovidona (E1208)
Poloxámero 188
Celulosa microcristalina (E460i)
Ácido succínico (E363)
Crospovidona (E1202)
Sílice coloidal anhidra (E551)
Estearato de magnesio (E470b)
Cubierta de la cápsula
Gelatina (E441)
Dióxido de titanio (E171),
Óxido de hierro rojo (E172)
Óxido de hierro amarillo (E172)
Óxido de hierro negro (E172)
Tinta de impresión
Goma laca (E904)
Óxido de hierro negro (E172)
Propilenglicol (E1520)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
Conservar por debajo de 30ºC.
Conservar en el embalaje original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Braftovi 50 mg cápsulas duras
Cada envase contiene 28×1 o 112×1 cápsulas duras en blíster precortado unidosis de poliamida/aluminio/PVC/aluminio/PET /papel.
Puede que solamente estén comercializados algunos tamaños de envases.
Braftovi 75 mg cápsulas duras
Cada envase contiene 42×1 o 168×1 cápsulas duras en blíster precortado unidosis de poliamida/aluminio/PVC/aluminio/PET /papel.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
-
7. Titular de la autorización de comercialización
PIERRE FABRE MEDICAMENT
Les Cauquillous
81500 Lavaur
Francia
-
8. Número(s) de autorización de comercialización
Braftovi 50 mg cápsulas duras
EU/1/18/1314/001 28×1 cápsulas duras
EU/1/18/1314/003 112×1 cáspulas duras
Braftovi 75 mg cápsulas duras
EU/1/18/1314/002 42×1 cápsulas duras
EU/1/18/1314/004 168×1 cáspulas duras
-
9. Fecha de la primera autorización/revocación de la autorización
Fecha de la primera autorización: 20/Septiembre/2018.
Fecha de la última renovación: 23/junio/2023
-
10. Fecha de la revisión del texto
Diciembre 2023
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
-
11. Presentación, precio de venta al público y condiciones de financiación
PARA LA INDICACIÓN: En combinación con binimetinib en adultos para el tratamiento del melanoma no resecable o metastásico con mutación BRAF V600: Braftovi 50 mg cápsulas duras: Caja con 28 cápsulas: PVP: 796,14€ y PVP IVA: 827,98€. Braftovi 75 mg cápsulas duras: Caja con 42 cápsulas: PVP: 1.721,42€ y PVP IVA: 1.790,27€. “Comprobar PVP”.
-
12. Régimen y condiciones de prescripción y dispensación
Con receta médica. Diagnóstico Hospitalario. Financiado por el Sistema Nacional de Salud. PARA LA INDICACIÓN: En combinación con cetuximab, para el tratamiento de pacientes adultos con cáncer colorrectal metastásico (CCRm) con mutación BRAF V600E, que han recibido terapia sistémica previa: Está pendiente la obtención del precio, así como el régimen y condiciones de prescripción y dispensación.
-
1. Nombre del medicamento
Mektovi 15 mg comprimidos recubiertos con película.
-
2.Composición cualitativa y cuantitativa de los principios activos, y la composición cualitativa de los excipientes de obligada declaración
Cada comprimido, recubierto con película, contiene 15 mg de binimetinib. Excipiente con efecto conocido: Cada comprimido, recubierto con película, contiene 133,5 mg de lactosa monohidrato.
-
3. Datos clínicos
3.1 Indicaciones terapéuticas: Binimetinib en combinación con encorafenib está indicado en pacientes adultos para el tratamiento del melanoma no resecable o metastásico con mutación BRAF V600 (ver la sección 3.4). 3.2 Posología y forma de administración: El tratamiento con binimetinib en combinación con encorafenib se debe iniciar y supervisar bajo la responsabilidad de un médico con experiencia en el uso de medicamentos antineoplásicos. Posología: La dosis recomendada de binimetinib es de 45 mg (tres comprimidos de 15 mg) dos veces al día, lo que corresponde a una dosis total diaria de 90 mg, con una diferencia aproximada de 12 horas entre tomas. Modificación de la dosis: Para controlar las reacciones adversas, puede ser necesario reducir la dosis, interrumpir temporalmente la administración o suspender el tratamiento (ver a continuación, las tablas 1 y 2). Para pacientes que reciben 45 mg de binimetinib dos veces al día, la dosis reducida de binimetinib recomendada es de 30 mg dos veces al día. No se recomiendan reducciones de la dosis por debajo de 30 mg dos veces al día. El tratamiento se debe suspender si el paciente no tolera la dosis de 30 mg dos veces al día por vía oral. Si las reacciones adversas que obligaron a reducir la dosis se han controlado eficazmente, se puede considerar la posibilidad de volverla a subir la dosis a 45 mg dos veces al día. No se recomienda subir de nuevo la dosis a 45 mg dos veces al día cuando lo que obligó a reducirla fue una disfunción del ventrículo izquierdo (DVI) o cualquier toxicidad de Grado 4. En las tablas 1 y 2, a continuación, se indican las modificaciones de dosis recomendadas en caso de reacciones adversas. Si se produce toxicidad relacionada con el tratamiento cuando se utiliza binimetinib en combinación con encorafenib, ambos tratamientos deben reducirse, interrumpirse o suspenderse de manera simultánea. Las excepciones en las que solo es necesario reducir la dosis de encorafenib (reacciones adversas relacionadas principalmente con encorafenib) son: el síndrome de eritrodisestesia palmoplantar (EPP), la uveítis, la iritis e iridociclitis, y intervalo QTc prolongado. Si se produce alguna de estas toxicidades, ver sección 4.2 de la ficha técnica de encorafenib para obtener instrucciones sobre la modificación de la dosis del encorafenib. Si se interrumpe de forma temporal la administración de binimetinib, se debe reducir la dosis de encorafenib a 300 mg una vez al día mientras dure la interrupción de binimetinib (ver las tablas 1 y 2), ya que encorafenib no es bien tolerado a dosis de 450 mg en monoterapia. Si se suspende de forma permanente la administración de binimetinib, se debe suspender el tratamiento con encorafenib. Si se interrumpe de forma temporal la administración de encorafenib (ver sección 4.2 de la ficha técnica de encorafenib), se debe interrumpir también la de binimetinib. Si se suspende de manera permanente la administración de encorafenib, se debe suspender también la de binimetinib. ara obtener más información sobre la posología y las modificaciones de dosis recomendadas de encorafenib, ver sección 4.2 de la ficha técnica de encorafenib.
Binimetinib Reacciones cutáneas · Grado 2 Se debe continuar con binimetinib. Si la erupción empeora o no mejora en el plazo de 2 semanas de tratamiento, se debe suspender la administración de binimetinib hasta que mejore a Grado 0 o 1 y, luego, reanudar a la misma dosis si es el primer acontecimiento o a una dosis reducida si es de Grado 2 recurrente.
· Grado 3 Se debe suspender la administración de binimetinib hasta mejoría a Grado 0 o 1 y reanudar a la misma dosis si es el primer acontecimiento o a una dosis reducida si es de Grado 3 recurrente. · Grado 4 Se debe suspender de forma permanente el tratamiento con binimetinib. Acontecimientos oculares · Desprendimiento del epitelio pigmentario retiniano (DEPR) de Grado 2 o 3 Se debe suspender la administración de binimetinib durante un máximo de 2 semanas y repetir el control oftalmológico, incluida la evaluación de la agudeza visual. · Si mejora a Grado 0 o 1, se debe reanudar binimetinib a la misma dosis.
· Si mejora a Grado 2, se debe reanudar binimetinib a una dosis menor.
· Si no mejora a Grado 2, se debe suspender de forma permanente el tratamiento con binimetinib.
· DEPR sintomático (Grado 4) asociado a una reducción de la agudeza visual (Grado 4) Se debe suspender de forma permanente el tratamiento con binimetinib. · Oclusión venosa retiniana (OVR) Se debe suspender de forma permanente el tratamiento con binimetinib. Acontecimientos cardíacos · Disminución de la fracción de eyección del ventrículo izquierdo (FEVI) de Grado 2 o descenso absoluto asintomático de la FEVI en más del 10 % respecto al valor basal y que esté por debajo del límite inferior normal (LIN) Se debe evaluar la FEVI cada 2 semanas. · Si es asintomática:
Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. Se debe reanudar el tratamiento con binimetinib a dosis reducida si se cumplen todas las condiciones siguientes en el transcurso de 4 semanas:
o FEVI en o por encima del LIN.
o Descenso absoluto del 10 % o menos respecto al valor basal.
· Si la FEVI no se recupera en 4 semanas, se debe suspender de forma permanente el tratamiento con binimetinib.
· Disminución de la FEVI de Grado 3 o 4 o disfunción del ventrículo izquierdo sintomática Se debe suspender de forma permanente el tratamiento con binimetinib. Se debe evaluar la FEVI cada 2 semanas hasta la recuperación.
Rabdomiolisis/elevación de la creatinfosfoquinasa (CK, por sus siglas en inglés) · Grado 3 (CK >5 – 10 veces el límite superior normal (LSN)) asintomática Se debe mantener la dosis de binimetinib y procurar una hidratación adecuada del paciente. · Grado 4 (CK >10 veces el LSN) asintomática Se debe suspender la administración de binimetinib hasta que mejore a Grado 0 o 1. Se debe procurar una hidratación adecuada del paciente. · Grado 3 o Grado 4 (CK >5 veces el LSN) con síntomas musculares o insuficiencia renal
Se debe suspender la administración de binimetinib hasta que mejore a Grado 0 o 1. · Si se resuelve en 4 semanas, se debe reanudar el tratamiento con binimetinib a dosis reducida o
· Se debe suspender de forma permanente el tratamiento con binimetinib.
Tromboembolismo venoso (TEV) · Trombosis venosa profunda (TVP) no complicada o embolia pulmonar (EP) ≤ Grado 3 Se debe suspender la administración de binimetinib. · Si mejora a Grado 0 o 1, Se debe reanudar el tratamiento con binimetinib a una dosis menor, o
· Si no mejora, Se debe suspender de forma permanente el tratamiento con binimetinib.
· EP de Grado 4 Se debe suspender de forma permanente el tratamiento con binimetinib. Anomalías en las analíticas hepáticas · Grado 2 aspartato aminotransferasa (AST) o alanina aminotransferasa (ALT) >3 a ≤5 veces el límite superior normal (LSN)) Se debe continuar con binimetinib. Si no se produce mejoría en 2 semanas, se debe suspender la administración de binimetinib hasta que mejore a Grado 0 o 1 o a los valores iniciales y, después, reanudar el tratamiento a la misma dosis.
· Primer acontecimiento de Grado 3 (AST o ALT >5 veces el LSN y bilirrubina en sangre >2 veces el LSN) Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. • Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanudar el tratamiento binimetinib a dosis reducida, o
• Si no mejora, se debe suspender de forma permanente el tratamiento con binimetinib.
· Primer acontecimiento de Grado 4 (AST o ALT >20 LSN) Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. • Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanudar el tratamiento con binimetinib a dosis reducida, o
• Si no mejora, se debe suspender de forma permanente el tratamiento con binimetinib.
O bien se debe suspender de forma permanente el tratamiento con binimetinib.
· Acontecimiento recurrente de Grado 3 (AST o ALT >5 veces el LSN y bilirrubina en sangre >2 veces el LSN) Se debe considerar suspender de forma permanente el tratamiento con binimetinib. · Acontecimiento recurrente de Grado 4 (AST o ALT >20 veces el LSN) Se debe suspender de forma permanente el tratamiento con binimetinib. Enfermedad pulmonar intersticial (EPI)/neumonitis · Grado 2 Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1, se debe reanudar el tratamiento con binimetinib a dosis reducida, o
· Si no se resuelve en 4 semanas, se debe suspender de forma permanente el tratamiento con binimetinib.
· Grado 3 o Grado 4 Se debe suspender de forma permanente el tratamiento con binimetinib. a Criterios Terminológicos Comunes para Acontecimientos Adversos del Instituto Nacional del Cáncer de los Estados Unidos (NCI- CTCAE, por sus siglas en inglés) versión 4.03
Tabla 2: Modificaciones de la dosis recomendada para binimetinib (utilizado en combinación con encorafenib) para otras reacciones adversas
Grado de la reacción adversa Binimetinib · Reacciones adversas recurrentes o intolerables de Grado 2 · Primer acontecimiento de reacciones adversas de Grado 3
Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanudar el tratamiento con binimetinib a dosis reducida, o
· Si no mejora, se debe suspender de forma permanente el tratamiento con binimetinib.
· Primer acontecimiento de reacciones adversas de Grado 4 Se debe suspender la administración de binimetinib durante un máximo de 4 semanas. · Si mejora a Grado 0 o 1 o a los valores iniciales, se debe reanudar el tratamiento con binimetinib a dosis reducida, o
· Si no mejora, se debe suspender de forma permanente el tratamiento con binimetinib.
O bien se debe suspender de forma permanente el tratamiento con binimetinib.
· Reacciones adversas recurrentes de Grado 3 Se debe considerar suspender de forma permanente el tratamiento con binimetinib. · Reacciones adversas recurrentes de Grado 4 Se debe suspender de forma permanente el tratamiento con binimetinib. Duración del tratamiento: El tratamiento continuará hasta que el paciente deje de obtener beneficios del mismo o hasta la aparición de toxicidad inaceptable. Dosis olvidadas: Si se olvida una dosis de binimetinib, no debe tomarla si faltan menos de 6 horas hasta la toma programada de la dosis siguiente. Vómitos: Si el paciente sufre vómitos tras la administración de binimetinib, no debe tomar una dosis adicional, sino esperar hasta la siguiente dosis programada. Poblaciones especiales: Pacientes de edad avanzada: No son necesarios ajustes de la dosis para pacientes mayores de 65 años. Insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve (Child Pugh A). Dado que el encorafenib no se recomienda en pacientes con insuficiencia hepática moderada (Child Pugh B) o grave (Child Pugh C), no se recomienda la administración de binimetinib en estos pacientes. (ver sección 4.2 de la ficha técnica de encorafenib). Insuficiencia renal: No se recomiendan ajustes de dosis en pacientes con insuficiencia renal. Población pediátrica: No se ha establecido todavía la seguridad y eficacia de binimetinib en niños y adolescentes. No se dispone de datos. Forma de administración: Mektovi es para vía oral. Los comprimidos deben tragarse enteros con agua. Pueden tomarse con o sin alimentos. 3.3 Contraindicaciones: Hipersensibilidad al principio activo o a alguno de los excipientes. 3.4 Advertencias y precauciones especiales de empleo: Binimetinib se debe administrar en combinación con encorafenib. Para obtener más información sobre las advertencias y precauciones relativas al tratamiento con encorafenib, ver sección 4.4 de la ficha técnica de encorafenib. Prueba de la mutación del gen BRAF: Antes de iniciar el tratamiento con binimetinib en combinación con encorafenib, se debe confirmar que los pacientes presentan la mutación BRAF V600 mediante una prueba validada. La eficacia y seguridad de binimetinib en combinación con encorafenib solo se ha establecido en pacientes con tumores que expresan las mutaciones BRAF V600E y V600K. Binimetinib en combinación con encorafenib no se debe utilizar en pacientes con melanoma maligno sin mutaciones del gen BRAF. Binimetinib combinado con encorafenib en pacientes cuya enfermedad ha progresado a un inhibidor de BRAF: Hay datos limitados relativos al uso de la combinación de binimetinib y encorafenib en pacientes cuyo melanoma no resecable o metastásico con mutación BRAF V600 ha progresado a un inhibidor de BRAF previo. Estos datos muestran que la eficacia de la combinación sería menor en estos pacientes. Binimetinib combinado con encorafenib en pacientes con metástasis cerebrales. Hay datos sobre eficacia limitados relativos a la combinación de binimetinib y encorafenib en pacientes con melanoma con mutación BRAF V600 que presentan metástasis cerebrales. Disfunción del ventrículo izquierdo (DVI): La administración de binimetinib puede producir DVI, definida como una disminución sintomática o asintomática de la fracción de eyección. Se recomienda evaluar la FEVI mediante ecocardiograma o ventriculografía con radionúclidos (MUGA) antes de comenzar el tratamiento con binimetinib, 1 mes después del inicio y luego cada 3 meses, aproximadamente, o con más frecuencia si está clínicamente indicado, mientras dure el tratamiento. Si se produce reducción de la FEVI, se puede abordar con una reducción de la dosis, la interrupción o suspensión del tratamiento (ver sección 3.2). No se ha confirmado la seguridad de binimetinib en combinación con encorafenib en pacientes con FEVI basal por debajo del 50 % o bien por debajo del LIN institucional. Por consiguiente, binimetinib se debe utilizar con precaución en estos pacientes; se suspenderá el tratamiento ante una disfunción ventricular izquierda sintomática, una disfunción de la FEVI de Grado 3 o 4 o un descenso absoluto de la FEVI ≥10 % respecto al valor inicial, y se evaluará la FEVI cada 2 semanas hasta la recuperación. Hemorragia: La administración de binimetinib puede provocar hemorragias, incluidos aconteciminetos hemorrágicos mayores (ver sección 3.8). El riesgo de hemorragia puede incrementarse con el uso concomitante de tratamientos anticoagulantes y antiagregantes plaquetarios. Los acontecimientos hemorrágicos de Grado ≥3 se deben tratar mediante la reducción de la dosis, la interrupción o suspensión del tratamiento (ver tabla 2 en la sección 3.2) y como esté clínicamente indicado. Toxicidad ocular: La administración de binimetinib puede provocar toxicidad ocular, como DEPR y OVR. Se ha notificado también uveítis, como iridociclitis e iritis, en pacientes tratados con binimetinib en combinación con encorafenib (ver sección 3.8). No se recomienda la administración de binimetinib a pacientes con antecedentes de OVR. No se ha estudiado la seguridad de binimetinib en pacientes con factores predisponentes para OVR, como: glaucoma no controlado, hipertensión ocular, diabetes mellitus no controlada o antecedentes de síndromes de hiperviscosidad o hipercoagulabilidad. Por tanto, binimetinib se debe administrar con precaución a estos pacientes. Los pacientes se deben someter a controles en cada consulta para detectar posibles trastornos visuales nuevos o un empeoramiento de los ya existentes. Si se identifican síntomas de trastornos visuales nuevos o un empeoramiento de los ya existentes, como disminución de la visión central, visión borrosa o pérdida de visión, se recomienda realizar rápidamente una exploración oftalmológica. Si se produce DEPR sintomático, se puede controlar con una reducción de la dosis, la interrupción o suspensión del tratamiento (ver tabla 1 en la sección 3.2). El tratamiento con binimetinib se debe suspender de forma permanente si se produce OVR (ver tabla 1 en la sección 3.2). Si, durante el tratamiento, el paciente presenta uveítis, ver sección 4.2 de la ficha técnica de encorafenib para obtener indicaciones. Elevación de la CK y rabdomiólisis: Se han observado elevaciones asintomáticas de la CK en pacientes tratados con binimetinib (ver sección 3.8), y se han notificado casos poco frecuentes de rabdomiolisis. Se deben extremar las precauciones en pacientes con trastornos neuromusculares asociados a una elevación de la CK y rabdomiolisis. Se deben controlar mensualmente los niveles de CK y creatinina durante los primeros 6 meses de tratamiento y como esté clínicamente indicado. Se indicará al paciente que debe mantener una ingesta de líquidos adecuada durante el tratamiento. En función de la gravedad de los síntomas o del grado de elevación de la CK o la creatinina, podría ser necesario reducir la dosis, interrumpir o suspender de forma permanente el tratamiento con binimetinib (ver tabla 1 en sección 3.2). Hipertensión: El tratamiento con binimetinib puede producir hipertensión o empeorar la ya existente. Se debe medir la presión arterial en la situación basal y a lo largo del tratamiento, y controlar la hipertensión con los tratamientos habituales si es necesario. En caso de hipertensión grave, se recomienda interrumpir temporalmente la administración de binimetinib hasta que esté controlada (ver tabla 2 en la sección 3.2). Tromboembolismo venoso (TEV): La administración de binimetinib puede producir TEV (ver sección 3.8). Binimetinib se debe utilizar con precaución en pacientes con riesgo o antecedentes de TEV. Si el paciente sufre TEV o embolia pulmonar, se debe tratar mediante la reducción de la dosis, la interrupción o la suspensión del tratamiento (ver tabla 1 en sección 3.2). Neumonitis/Enfermedad pulmonar intersticial: La administración de binimetinib puede producir neumonitis/EPI. El tratamiento con binimetinib se debe suspender en pacientes con sospecha de neumonitis o EPI, incluidos aquellos que presentan síntomas pulmonares nuevos o progresivos, o signos como tos, disnea, hipoxia, opacidades reticulares o infiltrados pulmonares (ver tabla 1 en la sección 3.2). El tratamiento con binimetinib se debe suspender de forma permanente en pacientes diagnosticados de neumonitis o EPI. Nuevas neoplasias malignas primarias: Se han observado nuevas neoplasias malignas primarias, cutáneas y no cutáneas, en pacientes tratados con inhibidores del gen BRAF, las cuales también se pueden producir cuando se administra binimetinib en combinación con encorafenib (ver sección 3.8). Neoplasias malignas cutáneas: En pacientes tratados con binimetinib en combinación con encorafenib, se han observado neoplasias malignas cutáneas como carcinoma de células escamosas de la piel (CCEP), incluido el queratoacantoma. Se debe realizar una evaluación dermatológica antes de comenzar el tratamiento con binimetinib y encorafenib, cada 2 meses mientras dure el tratamiento y hasta 6 meses después de la suspensión del mismo. Las lesiones sospechosas deben controlarse mediante resección dermatológica y evaluación anatomopatológica. Se debe indicar a los pacientes que informen inmediatamente al médico si observan cualquier lesión cutánea nueva. El tratamiento con binimetinib y encorafenib debe continuar sin ninguna modificación de la dosis. Neoplasias malignas no cutáneas: Teniendo en cuenta su mecanismo de acción, encorafenib puede promover el desarrollo de neoplasias malignas relacionadas con la activación de los oncogenes RAS por mutación u otros mecanismos. Los pacientes que reciben binimetinib en combinación con encorafenib se deben someter a una exploración de cabeza y cuello, una tomografía computarizada (TC) de tórax/abdomen, exámenes anales, y pélvicos (en el caso de las mujeres) y hemograma completo, antes del inicio, durante y al final del tratamiento, cuando esté clínicamente indicado. Se debe considerar la suspensión permanente del tratamiento con binimetinib y encorafenib en pacientes que desarrollen neoplasias malignas no cutáneas positivas para mutaciones de RAS. Se debe evaluar con precaución la relación beneficio-riesgo antes de administrar binimetinib en combinación con encorafenib a pacientes con un cáncer previo o simultáneo relacionado con una mutación de RAS. Anomalías de las analíticas hepáticas: Se pueden observar anomalías analíticas hepáticas, como elevaciones de la AST y la ALT, durante el tratamiento con binimetinib (ver sección 3.8). Dichas anomalías analíticas hepáticas se deben vigilar antes de iniciar el tratamiento con binimetinib y encorafenib, al menos una vez al mes durante los primeros 6 meses de tratamiento y, posteriormente, cuando esté clínicamente indicado. Las anomalías de las analíticas hepáticas se deben controlar con una interrupción o reducción de la dosis, o la suspensión del tratamiento (ver tabla 1 en sección 3.2). Insuficiencia hepática: La principal vía de eliminación de binimetinib es el metabolismo hepático, sobre todo por glucuronidación. Dado que no se recomienda el uso de encorafenib en pacientes con insuficiencia hepática moderada (Child Pugh B) y grave (Child Pugh C), no se recomienda la administración de binimetinib en estos pacientes (ver la sección 3.2). Intolerancia a la lactosa: Mektovi contiene lactosa. Los pacientes con intolerancia hereditarias a la galactosa, deficiencia total de lactasa o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento. 3.5 Interacción con otros medicamentos y otras formas de interacción: Efectos de otros medicamentos sobre binimetinib: Binimetinib se metaboliza principalmente por acción de la enzima UGT1A1 mediante glucuronidación. Es poco probable que el alcance de las interacciones farmacológicas mediadas por la enzima UGT1A1 sea clínicamente relevante; sin embargo, ya que esto no se ha evaluado en un estudio clínico específico, los inductores (como rifampicina y fenobarbital) y los inhibidores (como indinavir, atazanavir y sorafenib) de la UGT1A1 se deben administrar con precaución. Aunque encorafenib es un inhibidor reversible relativamente potente de la UGT1A1, no se han observado diferencias clínicas en la exposición a binimetinib cuando este se administra de forma concomitante con encorafenib. Los inductores de las enzimas CYP1A2 (como la carbamazepina y la rifampicina) y los inductores del transporte de gpP (como la hierba de San Juan o la fenitoína) pueden disminuir la exposición a binimetinib, lo que podría provocar una disminución de la eficacia. Efectos de binimetinib sobre otros medicamentos: Binimetinib es un potencial inductor de CYP1A2, y se debe tener precaución cuando se usa con sustratos sensibles (como la duloxetina o la teofilina). Binimetinib es un inhibidor débil de OAT3, y se debe tener precaución cuando se usa con sustratos sensibles (como la pravastatina o el ciprofloxacino). 3.6 Fertilidad, embarazo y lactancia: Mujeres en edad fértil/anticoncepción femenina: Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con binimetinib y hasta 1 mes después de la última dosis. Embarazo: No hay datos relativos al uso de binimetinib en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción. No se recomienda utilizar binimetinib durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos. Si la paciente utiliza binimetinib durante el embarazo o se queda embarazada durante el tratamiento, debe ser informada de los daños potenciales para el feto. Lactancia: Se desconoce si binimetinib o sus metabolitos se excretan en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Mektovi tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre. Fertilidad: No existen datos relativos a los efectos de binimetinib sobre la fertilidad en seres humanos. 3.7 Efectos sobre la capacidad para conducir y utilizar máquinas: La influencia de binimetinib sobre la capacidad para conducir y utilizar máquinas es pequeña. Se han notificado alteraciones visuales en pacientes tratados con binimetinib durante los estudios clínicos. Se debe informar a los pacientes que no conduzcan ni utilicen máquinas si sufren alteraciones visuales o cualquier otra reacción adversa que pueda afectar a su capacidad para conducir y utilizar máquinas (ver las secciones 3.4 y 3.8). 3.8 Reacciones adversas: Resumen del perfil de seguridad: La seguridad de binimetinib (45 mg dos veces al día por vía oral) combinado con encorafenib (450 mg una vez al día por vía oral) (en adelante, denominado Combo 450) se evaluó en 274 pacientes con melanoma no resecable o metastásico y mutación BRAF V600, en dos estudios de fase II (CMEK162X2110 y CLGX818X2109) y un estudio de fase III (CMEK162B2301, Parte 1) (en adelante, «población global con Combo 450»). A la dosis recomendada (n = 274) en pacientes con melanoma no resecable o metastásico, las reacciones adversas más frecuentes (>25 %) en los pacientes tratados con binimetinib junto con encorafenib fueron: fatiga, náuseas, diarrea, vómitos, desprendimiento de retina, dolor abdominal, artralgia, elevación de la CK en sangre y mialgia. La seguridad de encorafenib (300 mg una vez al día por vía oral) en combinación con binimetinib (45 mg dos veces al día por vía oral) se evaluó en 257 pacientes con melanoma no resecable o metastásico y mutación BRAF V600 (en adelante, «población global con Combo 300»), en el estudio de fase III (CMEK162B2301, Parte 2). Las reacciones adversas más frecuentes (>25%) en los pacientes tratados con encorafenib 300 mg administrado junto con binimetinib fueron fatiga, náuseas y diarrea. Tabla de reacciones adversas: A continuación, se presentan las reacciones adversas clasificadas según la clasificación de órganos del sistema MedDRA y de acuerdo con su frecuencia, mediante la siguiente convención: muy frecuentes (≥1/10), frecuentes (de ≥1/100 a <1/10), poco frecuentes (de ³1/1.000 a <1/100), raras (de ³1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 3: Reacciones adversas en pacientes que reciben binimetinib en combinación con encorafenib a la dosis recomendada (n = 274)
Categoría de órgano o sistema Reacción adversa Frecuencia (todos los grados) Neoplasias benignas, malignas y no especificadas Carcinoma de células escamosas de la piela Frecuente Carcinoma basocelular* Frecuente Papiloma de piel* Frecuente Trastornos de la sangre y del sistema linfático Anemia Muy frecuente Trastornos del sistema inmunológico Hipersensibilidadb Frecuente Trastornos del sistema nervioso Neuropatía periférica* Muy frecuente Mareos* Muy frecuente Cefalea* Muy frecuente Disgeusia Frecuente Paresis facialc Poco frecuente Trastornos oculares Alteración visual* Muy frecuente DEPR* Muy frecuente Uveítis* Frecuente Trastornos cardiacos Disfunción del ventrículo izquierdod Frecuente Trastornos vasculares Hemorragiae Muy frecuente Hipertensión* Muy frecuente Tromboembolismo venosof Frecuente Trastornos gastrointestinales Dolor abdominal* Muy frecuente Diarrea* Muy frecuente Vómitos* Muy frecuente Náuseas Muy frecuente Estreñimiento Muy frecuente Colitisg Frecuente Pancreatitis* Poco frecuente Trastornos de la piel y del tejido subcutáneo Hiperqueratosis* Muy frecuente Erupción* Muy frecuente Piel seca* Muy frecuente Prurito* Muy frecuente Alopecia* Muy frecuente Fotosensibilidad* Frecuente Dermatitis acneiforme* Frecuente Síndrome de eritrodisestesia palmoplantar (EPP) Frecuente Eritema* Frecuente Paniculitis* Frecuente Trastornos musculoesqueléticos y del tejido conjuntivo Artralgia* Muy frecuente Trastornos musculares/mialgiah Muy frecuente Dolor de espalda Muy frecuente Dolor en las extremidades Muy frecuente Rabdomiolisis Poco frecuente Trastornos renales y urinarios Fallo renal* Frecuente Trastornos generales y alteraciones en el lugar de administración Pirexia* Muy frecuente Edema periféricoi Muy frecuente Fatiga* Muy frecuente Exploraciones complementarias Creatinfosfoquinasa (CK) en sangre elevada Muy frecuente Transaminasas elevadas* Muy frecuente γ-glutamil transferasa elevadas* Muy frecuente Creatinina en sangre elevada* Frecuente Fosfatasa alcalina (FA) en sangre elevada Frecuente Amilasa elevada Frecuente Lipasa elevada Frecuente * términos compuestos que incluyen más de un término preferente. a incluye queratoacantoma, carcinoma de células escamosas, carcinoma labial de células escamosas y carcinoma de células escamosas de la piel. b incluye angioedema, hipersensibilidad a fármacos, hipersensibilidad, vasculitis por hipersensibilidad y urticaria. c incluye trastorno del nervio facial, parálisis facial y paresis facial. d incluye disfunción del ventrículo izquierdo, disminución de la fracción de eyección, insuficiencia cardíaca y fracción de eyección anómala. e incluye hemorragia en distintos órganos, como hemorragia cerebral. f incluye embolia pulmonar, trombosis venosa profunda, embolia, tromboflebitis, tromboflebitis superficial y trombosis. g incluye colitis, colitis ulcerosa, enterocolitis y proctitis. h incluye mialgia, debilidad muscular, espasmo muscular, lesión traumática muscular, miopatía y miositis. i incluye retención de líquidos, edema periférico y edema localizado.
Cuando encorafenib se utilizó a una dosis de 300 mg una vez al día en combinación con binimetinib 45 mg dos veces al día (Combo 300) en el estudio CMEK162B2301-Parte 2, la categoría frecuencia fue inferior comparado con la población global con Combo 450 para las siguientes reacciones adversas: anemia, neuropatía periférica, hemorragia, hipertensión, prurito (frecuente); y colitis, amilasa elevada y lipasa elevada (poco frecuente). Descripción de reacciones adversas seleccionadas. Neoplasias malignas cutánea: Se notificó CCEP cuando se administró binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). Acontecimientos oculares: En la población global con Combo 450, se notificó EPP en el 29,6 % (81/274) de los pacientes. DEPR de Grado 1 (asintomático) en el 21,2 % (58/274) de los pacientes; de Grado 2 en el 6,6 % (18/274) de los pacientes y de Grado 3 en el 1,8 % (5/274) de los pacientes. La mayoría de los acontecimientos notificados fueron retinopatía, desprendimiento de retina, líquido subretiniano, edema macular y coriorretinopatía, y obligaron a modificar la dosis o interrumpir la administración en el 4,7 % (13/274) de los pacientes. La mediana del tiempo hasta aparición del primer acontecimiento de DEPR (de cualquier Grado) fue de 1,54 meses (intervalo de 0,03 a 17,5 meses). Se notificó alteración visual, que incluye visión borrosa y disminución de la agudeza visual, en el 21,5 % (59/274) de los pacientes. La alteración visual fue generalmente reversible. También se notificó uveítis cuando se administró binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó DEPR en el 12,5% (32/257) de los pacientes, que fue un acontecimiento de Grado 4 en el 0,4% (1/257) de los pacientes. Disfunción del ventrículo izquierdo: En la población global con Combo 450, se notificó DVI en el 8,4 % (23/274) de los pacientes. Se produjeron acontecimientos de Grado 3 en el 1,1 % (3/274) de los pacientes. La DVI obligó a la suspensión del tratamiento en el 0,4% (1/274) de los pacientes y obligó a modificar la dosis o interrumpir la administración en el 6,6% (18/274) de los pacientes. La mediana del tiempo hasta la primera aparición de DVI (de cualquier Grado) fue de 4,4 meses (intervalo de 0,03 a 21,3 meses) en pacientes con una FEVI inferior al 50 %. El valor medio de la FEVI disminuyó un 5,9 % en la población global con Combo 450: de una media del 63,9 % en la situación basal, al 58,1 %. La DVI fue por lo general reversible tras modificar la dosis o interrumpir la administración. Hemorragia: Se observaron acontecimientos hemorrágicos en el 17,9 % (49/274) de los pacientes en la población global con Combo 450. La mayoría de los casos fueron de Grado 1 o 2 (14,6 %), y el 3,3 % fueron de Grado 3 o 4. En unos pocos pacientes (0,7 % o 2/274) fue necesario interrumpir el tratamiento o reducir la dosis. Los acontecimientos hemorrágicos obligaron a suspender el tratamiento en el 1,1 % (3/274) de los pacientes. Los acontecimientos hemorrágicos más frecuentes fueron hematuria en el 3,3 % (9/274) de los pacientes, hemorragia rectal en el 2,9 % (8/274) de los pacientes y hematoquecia en el 2,9 % (8/274) de los pacientes. Un paciente sufrió una úlcera hemorrágica mortal con fallo multiorgánico. Se produjo hemorragia cerebral en el 1,5 % (4/274) de los pacientes, con resultado de muerte en 3 pacientes. Todos los acontecimientos se produjeron en el contexto de metástasis cerebrales nuevas o que progresaron. En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observaron acontecimientos hemorrágicos en un 6,6% (17/257) de los pacientes, que fueron de Grado 3-4 en un 1,6% (4/257) de los pacientes. Hipertensión: Se notificaron elevaciones de la presión arterial o empeoramiento de la hipertensión existente en el 11,7 % (32/274) de los pacientes tratados con Combo 450. Los acontecimientos de hipertensión notificados fueron de Grado 3 en el 5,5 % (15/274) de los pacientes, incluida crisis hipertensiva (0,4 % (1/274)). La hipertensión obligó a interrumpir la administración o al ajuste de dosis en el 2,9 % de los pacientes. Las reacciones adversas de hipertensión necesitaron tratamiento adicional en el 8,0 % (22/274) de los pacientes. Tromboembolismo venoso: Sufrieron TEV el 4,7 % (13/274) de los pacientes tratados con Combo 450, incluido un 2,2 % (6/274) de los pacientes que presentaron embolismo pulmonar. La TEV notificada en la población global con Combo 450, fue de Grado 1 o 2 en el 3,6 % (10/274) de los pacientes y de Grado 3 o 4 en el 1,1% (3/274) de los pacientes. La TEV obligó a suspender el tratamiento en el 1,1 % (3/274) de los pacientes, y a administrar tratamiento adicional en el 4,7 % (13/274) de los pacientes. Pancreatitis: Se notificó pancreatitis cuando se administró binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). Reacciones dermatológicas: Las reacciones dermatológicas pueden ocurrir cuando se usa binimetinib en combinación con encorafenib. Erupción: En la población global con Combo 450, se produjo erupción en el 19,7 % (54/274) de los pacientes. La mayoría de los casos fueron leves, y se notificaron acontecimientos de Grado 3 o 4 en el 0,7 % (2/274) de los pacientes. La erupción obligó a suspender el tratamiento en el 0,4 % (1/274) de los pacientes y a interrumpir la administración del fármaco o modificar la dosis en el 1,1 % (3/274) de los pacientes. Dermatitis acneiforme: Presentaron dermatitis acneiforme el 4,4% (12/274) de los pacientes tratados con Combo 450, fue de Grado 1 y 2, y ningún caso obligó a suspender el tratamiento. Se notificó la modificación de la dosis en el 0,7% (2/274) de los pacientes. Síndrome de eritrodisestesia palmoplantar: Puede aparecer EPP cuando se administra binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). Fotosensibilidad: En la población global con Combo 450, se observó fotosensibilidad en el 4,0% (11/274) de los pacientes. La mayoría de los acontecimientos fueron de Grado 1 o 2, y se notificaron acontecimientos de Grado 3 en el 0,4% (1/274) de los pacientes y ningún acontecimiento obligó a la suspensión del tratamiento. Se notificó la interrupción de la administración o modificación de la dosis en el 0,4% (1/274) de los pacientes. Paresia facial: Se notificó paresis facial cuando se usó binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). Elevación de la CK/rabdomiólisis: En la población global con Combo 450, se notificó elevación asintomática de la CK sanguínea en el 27,0 % (74/274) de los pacientes. La incidencia de reacciones adversas de Grado 3 o 4 fue del 5,8 % (16/274). La mediana del tiempo hasta la aparición del primer acontecimiento fue de 2,7 meses (intervalo: 0,5 a 17,5 meses). Se notificó rabdomiolisis en el 0,4 % (1/274) de los pacientes tratados con encorafenib en combinación con binimetinib. En este paciente, la rabdomiolisis se produjo junto con una elevación sintomática de la CK de Grado 4. Disfunción renal: Se observó elevación de la creatinina sanguínea y fallo renal cuando se administró binimetinib en combinación con encorafenib (ver sección 4.8 de la ficha técnica de encorafenib). Anomalías analíticas hepáticas: Las incidencias de anomalías analíticas hepáticas en la población global con Combo 450 se indica a continuación: Elevación de transaminasas: 15,7% (43/274) global; Grado 3 o 4: 5,5% (15/274). Elevación de la GGT: 14,6% (40/274) global; Grado 3 o 4: 8,4% (23/274). En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, las incidencias de anomalías de las analíticas hepáticas se presentan a continuación: Elevación de transaminasas: 13,2% (34/257) global; Grado 3 o 4: 5,4% (14/257). Elevación de la GGT: 14,0% (36/257) global; Grado 3 o 4: 4,7% (12/257). Trastornos gastrointestinales: En la población global con Combo 450, se observó diarrea en el 38 % (104/274) de los pacientes, que fue de Grado 3 o 4 en el 3,3 % (9/274) de los pacientes. La diarrea obligó a suspender el tratamiento en el 0,4 % de los pacientes y a interrumpir la administración o modificar la dosis en el 4,4 % de los pacientes. Se produjo estreñimiento en el 24,1 % (66/274) de los pacientes, que fue de Grado 1 o 2. Se notificó dolor abdominal en el 27,4 % (75/274) de los pacientes, que fue de Grado 3 en el 2,6 % (7/274) de los pacientes. Sufrieron náuseas el 41,6 % (114/274) de los pacientes, con acontecimientos de Grado 3 o 4 en el 2,6 % (7/274) de los pacientes. Sufrieron vómitos el 28,1 % (77/274) de los pacientes, con acontecimientos de Grado 3 o 4 en el 2,2 % (6/274) de los pacientes. En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observaron náuseas en el 27,2% (70/257) de los pacientes, que fueron de Grado 3 en el 1,6% (4/257) de los pacientes. Se produjeron vómitos en el 15,2% (39/257) de los pacientes, que fueron de Grado 3 en el 0,4% (1/257) de los pacientes. Se produjo diarrea en el 28,4% (73/257) de los pacientes, que fue de Grado 3 en el 1,6% (4/257) de los pacientes. Los trastornos gastrointestinales se trataron normalmente con el tratamiento habitual. Anemia: En la población global con Combo 450, se notificó anemia en el 19,7 % (54/274) de los pacientes, que fue de Grado 3 o 4 en el 4,7 % (13/274) de los pacientes. Ningún paciente tuvo que suspender el tratamiento debido a la anemia, aunque en el 1,5 % (4/274) fue necesario interrumpir la administración o modificar la dosis. En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó anemia en el 9,7% (25/257) de los pacientes, que fue de Grado 3-4 en el 2,7% (7/257) de los pacientes. Dolor de cabeza: En la población global con Combo 450, se produjo dolor de cabeza en el 21,5% (59/274) de los pacientes, que fue de Grado 3 en el 1,5% (4/274) de los pacientes. En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se notificó dolor de cabeza en un 12,1% (31/257) de los pacientes, que fue de Grado 3 en el 0,4% (1/257) de los pacientes. Fatiga: En la población global con Combo 450, se produjo fatiga en el 43,8% (120/274) de los pacientes, que fue de Grado 3 en el 2,9% (8/274) de los pacientes. En el estudio CMEK162B2301-Parte 2, en el grupo de Combo 300, se observó fatiga en un 33,5% (86/257) de los pacientes, con acontecimientos de Grado 3-4 en el 1,6% (4/257) de los pacientes. Poblaciones especiales: Pacientes de edad avanzada: En la población global con Combo 450 (n = 274), 194 pacientes (70,8 %) eran menores de 65 años, 65 pacientes (23,7 %) tenían entre 65 y 74 años y 15 pacientes (5,5 %) tenían más de 75 años. No se observaron diferencias globales en cuanto a seguridad y eficacia entre los pacientes de edad avanzada (≥65 años) y los más jóvenes. La proporción de pacientes que experimentaron efectos adversos y efectos adversos graves fue similar en pacientes ˂65 años y en aquellos de >65 años. Los efectos adversos más comunes registrados con mayor incidencia en pacientes ≥ 65 años en comparación con los pacientes menores de 65 años, incluyeron diarrea, prurito, elevación de la GGT y elevación de la fosfatasa alcalina en sangre. En el pequeño grupo de pacientes de ≥ 75 años (n = 15), los pacientes fueron más propensos a experimentar efectos adversos graves y efectos adversos que condujeron a la suspensión del tratamiento. Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. 3.9 Sobredosis: La máxima dosis de binimetinib en monoterapia evaluada en los estudios clínicos fue de 80 mg administrados dos veces al día por vía oral, y se asoció a toxicidad ocular (coriorretinopatía) y cutánea (dermatitis acneiforme). No existe un tratamiento específico para la sobredosis de binimetinib. En caso de sobredosis, se deben instaurar medidas de soporte con la adecuada vigilancia del paciente si es necesario. Puesto que binimetinib se une extensamente a las proteínas plasmáticas, es probable que la hemodiálisis no sea eficaz para el tratamiento de la sobredosis.
-
4. Incompatibilidades
No procede.
-
5. Instrucciones de uso/ manipulación:
Ninguna especial.
-
6. Nombre y dirección del titular de la autorización
PIERRE FABRE MEDICAMENT, Les Cauquillous, 81500 Lavaur, Francia
-
7. Presentación y precio de venta al público
Caja de 84 comprimidos: PVP: 3.386,93€ y PVP IVA: 3.522,40€. “Comprobar PVP”.
-
8. Régimen y condiciones de prescripción y dispensación
Con receta médica. Diagnóstico Hospitalario. Financiado por el Sistema Nacional de Salud.





